| Feladat: | 2014. évi Nemzetközi Fizika Diákolimpia 2. feladata | Korcsoport: - | Nehézségi fok: nehéz | |
| Füzet: | 2014/október, 426 - 429. oldal |  PDF | MathML PDF | MathML |
||
| Témakör(ök): | Nemzetközi Fizika Diákolimpia, Reális gázok állapotegyenlete (van der Waals-egyenlet), Görbületi nyomás | |||
| Hivatkozás(ok): | Feladatok megoldásai: 2014/november: 2014. évi Nemzetközi Fizika Diákolimpia 2. feladata | |||
|
A szöveg csak Firefox böngészőben jelenik meg helyesen. Használja a fenti PDF file-ra mutató link-et a letöltésre. A rész. Reális gáz állapotegyenlete (2 pont). A részecskék véges méretének figyelembevételével a gáz állapotegyenlete
kérdés (0,3 pont): Becsüld meg a konstans értékét, és fejezd ki a molekulák átmérőjével. A molekulák közti vonzó kölcsönhatás figyelembevételére van der Waals a következő állapotegyenletet javasolta, mely jól leírja a közegeket, mind a folyadék, mind a gáz fázisban:
Bizonyos kritikus hőmérséklet alatti hőmérsékletek esetén a (2) egyenlet izotermái a 3. ábra 1. jelű görbéjéhez hasonló, nem monoton függvények. Ezeket van der Waals-izotermáknak nevezzük. Ugyanezen az ábrán a 2. jelű görbe az ideális gáz megfelelő izotermáját mutatja. A valódi izotermák a van der Waals-izotermáktól abban különböznek, hogy az szakaszon a nyomás értéke konstans, melyet jelöl. A konstans szakasz a és térfogattal jelölt állapotok között helyezkedik el, ahol a két térfogat rendre a folyadék, illetve a gáz fázis móltérfogatát jelöli. A termodinamika második főtételét felhasználva J. Maxwell megmutatta, hogy a nyomás az az érték, amely mellett az ábrán látható I. és II. területek megegyeznek.  3. ábra. A folyadék‐gáz átmenethez tartozó van der Waals-izoterma (1. görbe), valamint az ideális gáz izotermája (2. görbe) A hőmérséklet növelésével az izotermák konstans szakasza egyetlen ponttá zsugorodik össze, amikor a hőmérséklet, illetve a nyomás elér egy bizonyos , illetve értéket. A és értékeket, melyek kísérletileg nagy pontossággal mérhetők, kritikus értékeknek nevezzük. kérdés (1,3 pont): Fejezd ki a van der Waals-egyenletben szereplő és paraméter értékét és segítségével. kérdés (0,2 pont): Víz esetében K és Pa. Add meg víz esetén az és paraméterek numerikus értékét. kérdés (0,2 pont): Becsüld meg a vízmolekulák átmérőjét. B rész. Gáz és folyadék fázis tulajdonságai (6 pont). A feladatnak ebben a részében C hőmérsékletű víz tulajdonságait vizsgáljuk gáz, illetve folyadék fázisban. Jól ismert, hogy ezen a hőmérsékleten a telített vízgőz nyomása Pa, a víz moláris tömege pedig Gáz fázis. Ésszerű feltételezés, hogy gáz halmazállapotában fennáll a egyenlőtlenség. kérdés (0,6 pont): Fejezd ki a térfogatot az , , és mennyiségek segítségével. Az ideális gáz állapotegyenletét használva kicsit más móltérfogat adódik, ami jól közelíti a fenti móltérfogatot. kérdés (0,3 pont): Határozd meg a gőz móltérfogatának a molekulák közti vonzóerő hatására bekövetkező relatív csökkenését, azaz a Ha a rendszer térfogatát alá csökkentjük, akkor a gőz általában elkezd lecsapódni. Azonban ha a gáz igen tiszta, akkor mechanikai szempontból metastabil állapotban is maradhat (ezt túlhűtött gőznek nevezünk). A metastabil állapot végső határa a móltérfogat. Állandó hőmérsékleten a túlhűtött gőz létezésének a feltétele: kérdés (0,7 pont): Add meg egyenlettel, és számold is ki numerikusan, hogy a telített vízgőz térfogata legfeljebb hányadrészére csökkenthető túlhűtéssel, azaz határozd meg a hányadost. Folyadék fázis. A víz folyékony halmazállapotában a van der Waals-állapotegyenlet használatakor ésszerű feltételezés, hogy a egyenlőség teljesül. kérdés (1 pont): Fejezd ki a víz móltérfogatát folyadék halmazállapotban az , , és mennyiségek segítségével. Feltételezve, hogy , határozd meg a víz következő jellemzőit. Ne lepődj meg, ha a kapott értékek némelyike nem egyezik a táblázatokban is megtalálható, jól ismert értékekkel. kérdés (0,3 pont): Fejezd ki a víz sűrűségét folyadék fázisban a , , , mennyiségek (némelyikének) segítségével, és határozd meg a sűrűség numerikus értékét is. kérdés (0,6 pont): Fejezd ki az kérdés (1,1 pont): Fejezd ki a víz (tömegegységre vonatkoztatott) párolgáshőjét a , , , mennyiségek segítségével, és add meg a párolgáshő numerikus értékét. kérdés (1,2 pont): Egyetlen molekula vastagságú vízréteget vizsgálva becsüld meg a víz felületi feszültségét. C rész. Folyadék‐gáz rendszer (3 pont). A Maxwell-szabály segítségével (a területek egyenlőségét kifejező egyszerű integrálással), a van der Waals-állapotegyenlet felhasználásával valamint a B részben alkalmazott közelítések figyelembevételével megmutatható, hogy a telített vízgőz nyomásának a hőmérséklettől való függése
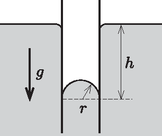 4. ábra. A nem nedvesítő folyadékba merülő kapilláris cső kérdés (1,3 pont): Fejezd ki a görbült folyadékfelszín fölötti telített vízgőz nyomásának kicsiny megváltozását a vízgőz sűrűsége, a folyadék sűrűsége, a felületi feszültség valamint a felszín görbületi sugara segítségével. A részben vizsgált metastabil állapotot sok kísérleti elrendezésben használják, például az elemi részecskék detektálására szolgáló ködkamrában is. A túlhűtött állapot természeti jelenségeknél is megfigyelhető, például a hajnali harmatképződésnél. A túlhűtött vízgőz folyadékcseppeket formálva csapódik ki. A nagyon kis méretű vízcseppek gyorsan elpárolognak, azonban a kellően nagyok tovább növekedhetnek. kérdés (1,7 pont): Tegyük föl, hogy este C hőmérsékleten a levegőben levő vízgőz telített, és hajnalra a környezet hőmérséklete kismértékben, C-kal csökken. Feltételezve, hogy a pára nyomása nem változik, becsüld meg azt a minimális sugarat, amelynél nagyobb vízcseppek mérete növekszik. Használd a víz felületi feszültségének irodalmi értékét: N/m. |