| Feladat: | 242. fizika mérési feladat | Korcsoport: - | Nehézségi fok: átlagos |
| Megoldó(k): | Juhász Anikó , Rakyta Péter , Sikó Lóránt , Szabó Áron , Szekeres Balázs , Szilágyi Péter , Vigh Máté | ||
| Füzet: | 2004/január, 57 - 60. oldal |  PDF | PDF |  MathML MathML |
|
| Témakör(ök): | Hőtani mérés, Mérési feladat | ||
| Hivatkozás(ok): | 1951/augusztus: Egyenlőtlenségek (2.)
Feladatok: 2003/április: 242. fizika mérési feladat, 1951/május: 286. matematika feladat | ||
|
A szöveg csak Firefox böngészőben jelenik meg helyesen. Használja a fenti PDF file-ra mutató link-et a letöltésre. Megoldás.1 Tekintsünk egy tömegű, tömegszázalékos oldatot. Kémiai tanulmányokból ismeretes, hogy egy ideális oldat (azaz amelyben az oldott részecskék között nincs kölcsönhatás) fagyáspontja jó közelítéssel lineárisan függ a molaritásban kifejezett koncentrációtól:
A méréshez szükséges glicerint2 gyógyszertárból szereztem be. Ez nem tiszta glicerin volt, hanem annak vizes oldata. (Különböző okok miatt tisztán nem forgalmazzák.) Az általam vásárolt 500 g oldat m/m%-os töménységű volt, sűrűsége . (Ezek az adatok pontosnak tekinthetők, a gyógyszertár dokumentációja szerint ez a ,,szabványa'' a gyógyszertári glicerinnek.) Az I. táblázat. A vizsgált oldatok összetétele Ha a fagyáspontot akarjuk meghatározni, nehézségekbe ütközünk, mivel az ,,éppen megfagyó'' oldat megfigyelése és hőmérsékletének mérése egy mélyhűtőben ‐ akár kívül, akár belül tartózkodunk ‐ kellemetlen feladat. A fagyásponttal definíciószerűen megegyező olvadáspont mérése azonban kényelmes; az oldatokat fagyáspontjuk alá kell hűteni, és felmelegítve az olvadás során kialakuló hőmérsékletet kell megfigyelni. A glicerin és a víz tömegét vízszintezett kétkarú mérleggel, hitelesített súlysorozattal mértem ki. Az elkészített oldatokat tiszta műanyag poharakban fagyasztóba tettem, és megvártam, míg az összes megfagy; ehhez (még a mélyhűtő leghidegebb, kb. A hőmérséklet mérésére A II. táblázat tartalmazza az I. táblázatban leírt adatok II. táblázat. A vizsgált oldatok fagyáspontja Az 1. grafikon mutatja az (1) elméleti görbét és a II. táblázat mérési pontjait. Az elméleti görbe ábrázolásánál a következő adatokkal számoltam: a vízre jellemző állandó: 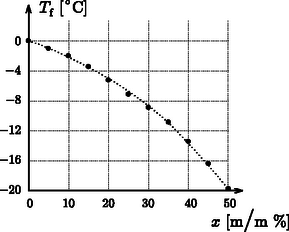 1. grafikon. A glicerin vizes oldatának fagyáspontja a koncentráció függvényében A grafikonról látható, hogy a mérési adatok igen jól illeszkednek az elméleti görbére. A glicerin vizes oldatának fagyáspontja a glicerin tömegszázalékának függvényében nemlineárisan csökken. Az oldatok fagyáspontjára kapott érték hibáját két független hibaforrás határozza meg: a tömegmérés, és ebből adódóan a tömegszázalék hibája, valamint a hőmérséklet mérésének hibája. A kétkarú mérleggel kb. 0,1 g pontossággal lehetett tömeget mérni. Ez azt jelenti, hogy az oldatokban levő víz és a glicerin tömege 0,1 g-mal eltérhet az I. táblázatban megadottaktól. Ez a glicerin tömegszázalékára nézve még a legrosszabb esetben sem jelent Az oldat fagyáspontjának hőmérsékletét Összességében a glicerin vizes oldatának fagyáspontját mintegy 0,2 1A mérési feladatoknál szokásos beszámolóktól eltérően most (csaknem változatlan alakban) egyetlen dolgozatot ismertetünk.2A tiszta glicerin adatai (Függvénytáblázat): fagyáspontja |