| Feladat: | 3280. fizika feladat | Korcsoport: 16-17 | Nehézségi fok: átlagos |
| Megoldó(k): | Antal Miklós , Horváth Eszter , Janáky Csaba , Seres András , Takács Gábor , Urbán Dániel | ||
| Füzet: | 2001/március, 182 - 183. oldal |  PDF | PDF |  MathML MathML |
|
| Témakör(ök): | Párolgás, forrás, lecsapódás, Feladat | ||
| Hivatkozás(ok): | Feladatok: 1999/október: 3280. fizika feladat | ||
|
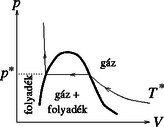
A szöveg csak Firefox böngészőben jelenik meg helyesen. Használja a fenti PDF file-ra mutató link-et a letöltésre. Vizsgáljuk meg, mi történik a vízgőzzel, ha a térfogatát csökkentjük, illetve ha növeljük. (Megfontolásaink során csak a vízgőzzel kell törődjünk, egyéb gázok jelenléte ─ Dalton törvénye szerint ─ a telítési nyomásra nincs hatással.) Ha a térfogatot olyan hirtelen növeljük meg, hogy nincs idő számottevő hőcserére a vízgőzt tartalmazó tartály és a környezete között, akkor a hőmérséklet lecsökken (adiabatikus tágulás). Az új, alacsonyabb hőmérséklethez tartozó telítési gőznyomás kisebb lesz, mint az eredeti, sőt, annak ellenére, hogy nő és csökken, a gőz egy része kicsapódik. A gőz kicsapódása tehát a térfogat csökkentésével és növelésével egyaránt előidézhető, a térfogatváltozás tényleges hatása a folyamat sebességétől függ.
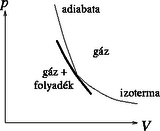
Ha a gázt a környezetétől adiabatikusan elzárva akarjuk cseppfolyósítani, akkor azt kell valamilyen módon elérnünk, hogy a hőmérséklet lecsökkenjen. Mivel most nincs hőátadás az első főtétel szerint . Ha a gáz végez munkát (vagyis ), a belső energia (és vele együtt a gáz hőmérséklete) le fog csökkenni. A gáz pedig akkor végez munkát, ha a térfogata nő. A vízgőz kicsapódásához tehát több út is vezethet: izotermikus folyamatban a térfogat csökkenése, adiabatikus folyamatban a térfogat növelése okozhat vízlecsapódást. A ‐ diagramon a gáz és a kétfázisú állapotokat egymástól elválasztó görbe elég széles tartományban alakú, ahol általában egy viszonylag kicsi pozitív szám. Vízgőz esetén kb. . Ez azt jelenti, hogy a határgörbe meredekebb, mint az izoterma (amelyre ideális gáz esetén ), de kevésbé meredek, mint az adiabata (amelyre termodinamikai szabadsági fokú ideális gázra ). 2. A hirtelen kitágított (s emiatt túltelítetté váló) vízgőz kicsapódásához ún. kondenzációs magok szükségesek. Ilyen magok lehetnek pl. koromszemcsék, vagy ionizált részecskék. Az előbbiek a repülőgép kondenzcsíkjának képződésekor, az utóbbiak az elemi részecskéket láthatóvá vevő Wilson-féle ködkamra működése során kapnak szerepet: a gyorsan mozgó, elektromosan töltött elemi részecskék ionokat keltenek, s az ezek által megindított folyadékcsepp-képződés ködfonalként jelöli ki a részecskék pályáját.
  |