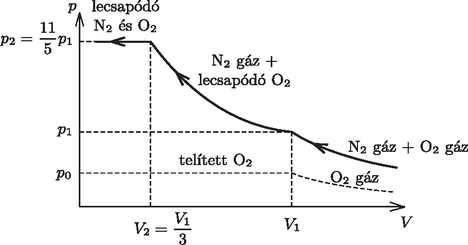
|
A szöveg csak Firefox böngészőben jelenik meg helyesen. Használja a fenti PDF file-ra mutató link-et a letöltésre. Megoldás. A állapotnál az izoterma törése ismerős: azt jelzi, hogy a gáz cseppfolyósodni kezd, ezért nem nő tovább a nyomása. De mi történt a állapotban? Miért változott meg itt az izoterma meredeksége? Figyeljünk fel arra, hogy a tartályban kétféle gáz keveréke található. Elképzelhető, hogy ezek nem egyszerre kezdenek cseppfolyósodni, hanem itt, a állapotban csak az egyik komponens kezd lecsapódni, a másik pedig még gáz halmazállapotú marad!
Vagyis összenyomás közben és között az egyik komponens nyomása már nem változik, a másiké pedig tovább nő. Ez a második komponens akkor kezd lecsapódni, amikor a tartály térfogata már -re csökkent. Ez a válasz az kérdésre. Hogy melyik gáz kezd hamarabb cseppfolyósodni, arra még csak tippelhetünk.
Tételezzük fel, hogy ez az oxigén.
Az kérdésre adott válasz alapján ábrázoltuk a folyamatot a diagramon (3. ábra).
A megadott adatokkal ( kPa és ) | p2=115p1=123,9kPaésV2=V13=5dm3. |
Az oxigén egyelőre ismeretlen p0 telítési nyomását abból számíthatjuk ki, hogy a nitrogén még a V1→V2 összenyomás közben is gáz maradt. Elhanyagolva a cseppfolyós oxigén térfogatát a tartályban, valamint a nitrogéngázt továbbra is ideális gáznak tekintve felírhatjuk rá a Boyle‐Mariotte-törvényt: Ebből az oxigén telítési nyomása p0=25p1=22,5 kPa.
Ennek segítségével felírhatjuk a nitrogén és az oxigén mólokban mért tömegének arányát: | nnitrogénnoxigén=p1-p0p0=32. |
Már csak egy összefüggés hiányzik a két mólszám között ahhoz, hogy kiszámíthassuk pontos értékeiket. Ez a keresett összefüggés abból adódik, hogy a két mólszám összege a mólokban mért teljes anyagmennyiség, amely kezdetben még (ideális) gáz volt, tehát érvényes rá az ideális gáz állapotegyenlete: Ebből nösszes (=nnitrogén+noxigén)=1,313 mól. Fentiek alapján, felhasználva a moláris tömegek értékét:
nnitrogén=0,788mól=22,1gramm,noxigén=0,525mól=16,8gramm.
Kizárólag a feladatban szereplő adatok segítségével nem lehet eldönteni, hogy az oxigén vagy a nitrogén kezd el hamarabb cseppfolyósodni.
Szöget üthet a fejünkben, hogy miért éppen a T=77,4 K-es izotermát kérdezi a feladat. Eszünkbe juthat (táblázatok alapján ellenőrizhetjük), hogy ez a hőmérséklet a folyékony nitrogén forráspontja normál légköri nyomáson (1 atm =1,013 ⋅105 Pa). Ez azt jelenti, hogy a nitrogén ezen a hőmérsékleten akkor kezd el cseppfolyósodni, ha a parciális nyomása eléri az 1 atmoszférát. A kezdőállapotban p1=56,3 kPa, vagyis ezen a nyomáson a nitrogén akkor sem kezdhetne el kondenzálódni, ha a gáz tiszta nitrogén lenne.
Érvelésünket úgy is megerősíthetjük, ha kiszámítjuk a p2-p0 nyomás értéket, mert ennek a különbségnek éppen 1 atmoszférának kell lenni, hiszen ez a telített nitrogéngőz nyomása 77,4 K-en. Ha a számításokat kerekítések nélkül végezzük, akkor p2=123,86 kPa és p0=22,52 kPa, vagyis a különbség 101,34 kPa, ami nagy pontossággal 1 atmoszféra.
Következtetésünket az is megerősíti, hogy a normál nyomású oxigén forráspontja (szintén táblázatokban megtalálható adat) 90,2 K, amiből az következik, hogy a telített oxigéngőz nyomása 77,4 K-en kisebb, mint a nitrogéné (1 atmoszféra), és valóban a megoldás részeredményeit felhasználva: A feladatban azért jelennek meg ezek az egyszerű törtek, mert véletlenül a telített nitrogén nyomása (1 atm) éppen négy és félszerese a telített oxigén nyomásának 77,4 K-en.
Kiegészítés (Honyek Gyula): Érdekességként említhetjük meg, hogy amennyiben észrevesszük, hogy a telített nitrogéngőz nyomása 77,4 K-en 1 atm, akkor a következő egyenleteket írhatjuk fel: | 115p1-p0=1atm. és p1 - p0 = 13 atm. |
Ezeknek az egyenleteknek a megoldása: | p0=29atm.=22,5kPa és p1 =59 atm.=56,3 kPa, |
vagyis azok számára, akik kihasználták, hogy normál légköri nyomáson a nitrogén forráspontja 77,4 K, a megadott p1=56,3 kPa adat felesleges volt.
|
 PDF |
PDF |  MathML
MathML