| Feladat: | 2427. fizika feladat | Korcsoport: 16-17 | Nehézségi fok: átlagos |
| Megoldó(k): | Vasas Péter | ||
| Füzet: | 1990/május, 235 - 236. oldal |  PDF | PDF |  MathML MathML |
|
| Témakör(ök): | Ideális gáz állapotegyenlete, Feladat | ||
| Hivatkozás(ok): | Feladatok: 1989/november: 2427. fizika feladat | ||
|
A szöveg csak Firefox böngészőben jelenik meg helyesen. Használja a fenti PDF file-ra mutató link-et a letöltésre. I. megoldás. Mivel a kiemelés után a gáz és a környezet között se hőcsere, se munkavégzés nem történik, ezért a gáz összes belső energiája állandó. 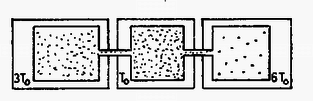 Mivel az egyes tartályokban a gáz nyomása megegyezik, valamint az egész rendszer összes térfogata állandó, , célszerű a belső energiát az képletből számolni: Vasas Péter (Mezőkövesd, I. László Gimn., I. o. t.) dolgozata alapján II. megoldás. Kiemelés előtt az egyes tartályok térfogata és nyomása azonos, ezért az mennyiség a tartályokban állandó ( =mólszám), , . Kiemelés után közös hőmérséklet alakul ki. A tartályok által felvett összes hő nulla: |