| Feladat: | 1966. fizika feladat | Korcsoport: 18- | Nehézségi fok: átlagos |
| Megoldó(k): | Barabás Tibor | ||
| Füzet: | 1985/április, 184 - 185. oldal |  PDF | PDF |  MathML MathML |
|
| Témakör(ök): | Közlekedőedény, Elektrolízis, Ideális gáz nyomásának értelmezése (alapegyenlet), Feladat | ||
| Hivatkozás(ok): | Feladatok: 1984/október: 1966. fizika feladat | ||
|
A szöveg csak Firefox böngészőben jelenik meg helyesen. Használja a fenti PDF file-ra mutató link-et a letöltésre. Kénsav elektrolízise során hidrogén és oxigén gáz keletkezik a következőképpen:
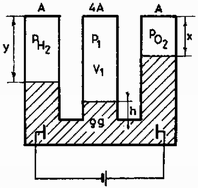 A kinetikus gázelmélet alapján a fejlődött gázok nyomása: Az egyensúly miatt a csövek végén a nyomások egyenlőek: A fejlődött gáz mennyisége olyan kicsiny, hogy elhanyagolhatjuk a folyadék térfogatváltozását:
(5a), (6a) és (7) , , -re egyenletrendszert alkot, amelynek fizikailag értelmes gyökei: Mivel 4 elektron szükséges egy oxigén molekula felszabadulásához, így az összes átáramlott töltés Megjegyzés. Sokan a hibás számolás miatt nem kaptak teljes pontszámot. Az eredmény ellenőrzésével (a feladatba való behelyettesítéssel) elkerülhették volna a pontlevonást. |