|
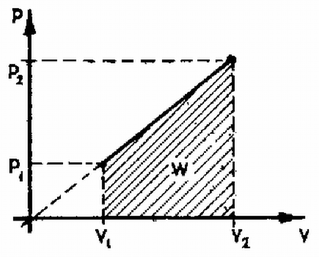
A szöveg csak Firefox böngészőben jelenik meg helyesen. Használja a fenti PDF file-ra mutató link-et a letöltésre. Adott anyag fajhőjét az egységnyi tömegű anyag -vel való felmelegítéséhez szükséges hő és a hányadosa adja meg, ahol -vel egy kis hőmérséklet‐változást jelöltünk. Természetesen ha lineárisan függ -től, akkor a hőmérséklet‐különbség tetszőlegesen nagy lehet. meghatározásához az I. főtételből indulunk ki: ahol a belső energia megváltozása, pedig a gázon végzett munka. Az ideális gáz belső energiája csak a hőmérséklettől függ és megváltozása: ahol a gáz állandó térfogaton mért fajhője, a tömege. A gázon, ill. esetünkben a gáz által végzett munkát a diagramon határozzuk meg; a munka az állapotváltozást jelző görbe alatti területtel egyenlő. A feladat szerint az állapotváltozás olyan, hogy a egyenlet teljesül. (3) képe az origón áthaladó egyenes. A görbe alatti területet az ábra alapján könnyen meghatározhatjuk. (A negatív előjel arra utal, hogy nem a gázon végzett munkát, hanem a gáz által végzett munkát számítjuk ki.) Ebbe (3)-t beírva kapjuk, hogy | | (5) |
Az ideális gáz állapotegyenletét beírva (5)-be, (3) felhasználásával kapjuk: (1)-ből (2) és (6) segítségével kifejezhetjük -t: amiből az állapotváltozásra jellemző fajhő ahol az 1 mol gáz tömegét jelöli. Egyatomos gáz esetén
Fodor Gyula (Budapest, Móricz Zs. Gimn., III. o. t.) |
 PDF |
PDF |  MathML
MathML