| Feladat: | 1054. fizika feladat | Korcsoport: 16-17 | Nehézségi fok: átlagos |
| Megoldó(k): | Balog János , Bari Ferenc | ||
| Füzet: | 1972/december, 233 - 235. oldal |  PDF | PDF |  MathML MathML |
|
| Témakör(ök): | Görbületi nyomás, Ideális gáz állapotegyenlete, I. főtétel, Feladat | ||
| Hivatkozás(ok): | Feladatok: 1972/április: 1054. fizika feladat | ||
|
A szöveg csak Firefox böngészőben jelenik meg helyesen. Használja a fenti PDF file-ra mutató link-et a letöltésre. Ha az sugarú léggömböt bevisszük a csarnokba, akkor sugara -re változik ; a gáz nyomása -ról -re nő. A gumi egy térfogatelemének (1‐2, ábra) egyensúlyából : , ahol a gumiban ébredt feszültségből származó nyomás. 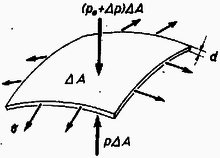 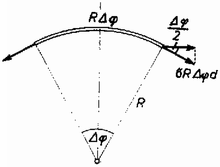 A térfogatelem oldallapjára erő hat, amelynek radiális irányú komponense (2. ábra) ; mivel a térfogatelem minden oldalára ilyen erő hat, ezért Normál nyomáson és hőmérsékleten a levegő sűrűsége ; nyomáson és hőmérsékleten . hőmérsékleten a léggömb súlya, a kötélerő és a felhajtóerő egyensúlyt tart : Ha függőlegesen felfelé mutat (a hőmérsékletű környezetben a léggömb felülről van rögzítve), akkor , azaz kp, s így , miatt a léggömb süllyedni fog a csarnokban elengedés után. A folyamat során a hidrogén nyomása a léggömb sugarának függvényében : Felhasználtuk, hogy , ahol a hidrogén tömege, a mólnyi tömege, az egyetemes gázállandó. Mivel a hidrogén kétatomos gáz, azért a fajhője állandó térfogaton). Számszerűen Megjegyzés. Több megoldó a tényleges tágulási folyamat helyett valamilyen más (pl. egy izochor és egy izobár részfolyamatból állt) folyamatot tekintett és abban számolta ki a gáz által felvett hőt. Így nem adódott helyes eredmény, mert a hőmennyiség nem állapotfüggvény, függ attól, hogy a rendszer milyen folyamat révén jutott egyik állapotból a másikba. Elég jó közelítés viszont, ha a folyamatot a nyomás -hoz képest kicsiny megváltozása miatt izobárnak tekintjük . |