| Feladat: | 176. fizika mérési feladat | Korcsoport: 16-17 | Nehézségi fok: átlagos |
| Megoldó(k): | Bános Noémi , Major Zsuzsanna , Megyeri Ágnes | ||
| Füzet: | 1996/november, 508 - 509. oldal |  PDF | PDF |  MathML MathML |
|
| Témakör(ök): | Hőtani mérés, Olvadás, fagyás, Mérési feladat | ||
| Hivatkozás(ok): | Feladatok: 1996/január: 176. fizika mérési feladat | ||
|
A szöveg csak Firefox böngészőben jelenik meg helyesen. Használja a fenti PDF file-ra mutató link-et a letöltésre. A sóoldat készítését Megyeri Ágnes (Monor, József A. Gimn., I. o.t.) a következőképpen oldotta meg. Egy pohárba levélmérlegen kimért 100 gramm vizet, majd 5 gramm sót adagolt hozzá. Hasonló módon 5 grammonként 35 grammig növelve a só mennyiségét töményebb oldatokat is készített. (37 grammnál több sót szobahőmérsékleten nem tudott feloldani.) A sóoldatból vett mintákat műanyagflakon kupakjába tette, s így rakta a C hőmérsékletű mélyhűtőbe. Kb. 5 órai hűtés után a következőket tapasztalta. Az 5 grammos oldat teljesen megfagyott. A 10-es oldat is megfagyott, de egy hurkapálcával viszonylag könnyen szétdarabolható volt. A 15 gramm sót tartalmazó oldat is ,,összeállt'', de ujjal szétmorzsolható volt. A 20 g-os oldat állaga kocsonyaszerű, enyhén rugalmas volt. A 25-ös oldat folyékony maradt, de itt-ott mutatkoztak benne (ujjal kitapintható) apró jégdarabok. A 30 grammos oldat tisztán folyékony maradt, míg a 35-ösből a folyadék alján só vált ki. Végül a legtöményebb, a 37 gramm sót tartalmazó oldatból erőteljesen kivált a só. Ezekből a megfigyelésekből arra következtetett, hogy 100 g vízben kb. 27 g és 33 g közötti só oldható fel úgy, hogy C-on se jég, se só ne váljon ki az oldatból. Megjegyzések: 1. Ha különböző mérési adatokat egymással, vagy az ,,irodalmi értékekkel'' össze akarunk hasonlítani, akkor vigyáznunk kell az ,, százalékos'' oldat kifejezés értelmezésével. A keverék aránya jelenthet térfogatszázalékos, vagy súlyszázalékos arányt. Folyadékoknál a térfogatot, szilárd anyagoknál a tömeget könnyebb mérni, ez határozhatja meg, hogy melyik arányt célszerű használnunk. De még a súlyszázalékos arány kifejezés sem egyértelmű, hiszen pl. a só tömegét viszonyíthatjuk a víz tömegéhez, de az egész oldat tömegéhez is. (Mindkét értelmezésre akadt példa a beküldött mérési jegyzőkönyvekben.) A különböző arányszámok egymásba nyilván átszámíthatók, de ehhez az szükséges, hogy egyértelműen megadjuk, mikor melyikről van éppen szó. 2. A kétkomponensű elegyek (pl. só + víz) halmazállapotát a hőmérséklet függvényében az ábrán látható ,,fázisdiagrammal'' lehet szemléltetni. Erről leolvasható, hogy adott hőmérsékleten milyen hatáok közötti sókoncentráció esetén maradhat az oldat telítetlen. Az is látható, hogy ha bizonyos koncentrációjú oldatot (például az pontnak megfelelőt) hűteni kezdünk, az oldat összetétele egy ideig nem változik, majd a telítetlen‐telített oldat határgörbéjét elérve a fokozatos jégkiválás (a pontból indulva sókiválás) indul meg. Ezután a fokozatosan változó koncentrációjú oldat nem egy meghatározott hőmérsékleten, hanem egy bizonyos hőmérséklet‐intervallumban fagy meg. Kivételt képez az (ún. eutektikus) pontnak megfelelő összetétel; az ilyen oldatoknak határozott fagyáspontja van. Konyhasó esetén az eutektikus összetétel 23 súlyszázalék (), a megfelelő eutektikus hőmérséklet (a legalacsonyabb fagyási hőmérséklet) pedig 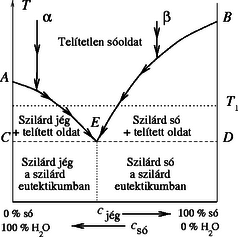 |