| Cím: | A 45. Nemzetközi Fizikai Diákolimpia elméleti feladatai | ||
| Füzet: | 2014/október, 425 - 431. oldal |  PDF | MathML PDF | MathML |
|
| Témakör(ök): | Szakmai cikkek | ||
|
A szöveg csak Firefox böngészőben jelenik meg helyesen. Használja a fenti PDF file-ra mutató link-et a letöltésre. elméleti feladatai 1 1. feladat (összesen 9 pont). 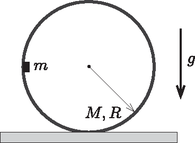 1. ábra 1) Vezesd le a buborékban lévő gáz moláris hőkapacitásának képletét egy olyan folyamatra, amelyben a gázt olyan lassan melegítjük, hogy a buborék mindvégig egyensúlyban van. Add meg a numerikus eredményt is. 2) Vezesd le és számítsd ki a buborék sugárirányú rezgésének körfrekvenciáját azt feltételezve, hogy a buborék falának hőkapacitása sokkal nagyobb, mint a buborékban lévő gáz hőkapacitása. Azt is feltételezd, hogy a buborék belsejében a termikus egyensúly sokkal gyorsabban alakul ki, mint a rezgés periódusideje. Segítség: Laplace bebizonyította, hogy egy görbült határfelület külső és belső oldala közt a felületi feszültség következtében nyomáskülönbség van, ami .  2. ábra A rész. Reális gáz állapotegyenlete (2 pont). A részecskék véges méretének figyelembevételével a gáz állapotegyenlete
kérdés (0,3 pont): Becsüld meg a konstans értékét, és fejezd ki a molekulák átmérőjével. A molekulák közti vonzó kölcsönhatás figyelembevételére van der Waals a következő állapotegyenletet javasolta, mely jól leírja a közegeket, mind a folyadék, mind a gáz fázisban:
Bizonyos kritikus hőmérséklet alatti hőmérsékletek esetén a (2) egyenlet izotermái a 3. ábra 1. jelű görbéjéhez hasonló, nem monoton függvények. Ezeket van der Waals-izotermáknak nevezzük. Ugyanezen az ábrán a 2. jelű görbe az ideális gáz megfelelő izotermáját mutatja. A valódi izotermák a van der Waals-izotermáktól abban különböznek, hogy az szakaszon a nyomás értéke konstans, melyet jelöl. A konstans szakasz a és térfogattal jelölt állapotok között helyezkedik el, ahol a két térfogat rendre a folyadék, illetve a gáz fázis móltérfogatát jelöli. A termodinamika második főtételét felhasználva J. Maxwell megmutatta, hogy a nyomás az az érték, amely mellett az ábrán látható I. és II. területek megegyeznek. 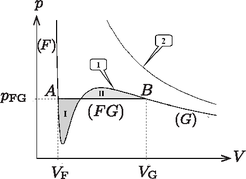 3. ábra. A folyadék‐gáz átmenethez tartozó van der Waals-izoterma (1. görbe), valamint az ideális gáz izotermája (2. görbe) A hőmérséklet növelésével az izotermák konstans szakasza egyetlen ponttá zsugorodik össze, amikor a hőmérséklet, illetve a nyomás elér egy bizonyos , illetve értéket. A és értékeket, melyek kísérletileg nagy pontossággal mérhetők, kritikus értékeknek nevezzük. kérdés (1,3 pont): Fejezd ki a van der Waals-egyenletben szereplő és paraméter értékét és segítségével. kérdés (0,2 pont): Víz esetében K és Pa. Add meg víz esetén az és paraméterek numerikus értékét. kérdés (0,2 pont): Becsüld meg a vízmolekulák átmérőjét. B rész. Gáz és folyadék fázis tulajdonságai (6 pont). A feladatnak ebben a részében C hőmérsékletű víz tulajdonságait vizsgáljuk gáz, illetve folyadék fázisban. Jól ismert, hogy ezen a hőmérsékleten a telített vízgőz nyomása Pa, a víz moláris tömege pedig Gáz fázis. Ésszerű feltételezés, hogy gáz halmazállapotában fennáll a egyenlőtlenség. kérdés (0,6 pont): Fejezd ki a térfogatot az , , és mennyiségek segítségével. Az ideális gáz állapotegyenletét használva kicsit más móltérfogat adódik, ami jól közelíti a fenti móltérfogatot. kérdés (0,3 pont): Határozd meg a gőz móltérfogatának a molekulák közti vonzóerő hatására bekövetkező relatív csökkenését, azaz a Ha a rendszer térfogatát alá csökkentjük, akkor a gőz általában elkezd lecsapódni. Azonban ha a gáz igen tiszta, akkor mechanikai szempontból metastabil állapotban is maradhat (ezt túlhűtött gőznek nevezünk). A metastabil állapot végső határa a móltérfogat. Állandó hőmérsékleten a túlhűtött gőz létezésének a feltétele: kérdés (0,7 pont): Add meg egyenlettel, és számold is ki numerikusan, hogy a telített vízgőz térfogata legfeljebb hányadrészére csökkenthető túlhűtéssel, azaz határozd meg a hányadost. Folyadék fázis. A víz folyékony halmazállapotában a van der Waals-állapotegyenlet használatakor ésszerű feltételezés, hogy a egyenlőség teljesül. kérdés (1 pont): Fejezd ki a víz móltérfogatát folyadék halmazállapotban az , , és mennyiségek segítségével. Feltételezve, hogy , határozd meg a víz következő jellemzőit. Ne lepődj meg, ha a kapott értékek némelyike nem egyezik a táblázatokban is megtalálható, jól ismert értékekkel. kérdés (0,3 pont): Fejezd ki a víz sűrűségét folyadék fázisban a , , , mennyiségek (némelyikének) segítségével, és határozd meg a sűrűség numerikus értékét is. kérdés (0,6 pont): Fejezd ki az kérdés (1,1 pont): Fejezd ki a víz (tömegegységre vonatkoztatott) párolgáshőjét a , , , mennyiségek segítségével, és add meg a párolgáshő numerikus értékét. kérdés (1,2 pont): Egyetlen molekula vastagságú vízréteget vizsgálva becsüld meg a víz felületi feszültségét. C rész. Folyadék‐gáz rendszer (3 pont). A Maxwell-szabály segítségével (a területek egyenlőségét kifejező egyszerű integrálással), a van der Waals-állapotegyenlet felhasználásával valamint a B részben alkalmazott közelítések figyelembevételével megmutatható, hogy a telített vízgőz nyomásának a hőmérséklettől való függése
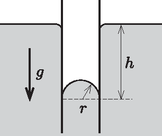 4. ábra. A nem nedvesítő folyadékba merülő kapilláris cső kérdés (1,3 pont): Fejezd ki a görbült folyadékfelszín fölötti telített vízgőz nyomásának kicsiny megváltozását a vízgőz sűrűsége, a folyadék sűrűsége, a felületi feszültség valamint a felszín görbületi sugara segítségével. A részben vizsgált metastabil állapotot sok kísérleti elrendezésben használják, például az elemi részecskék detektálására szolgáló ködkamrában is. A túlhűtött állapot természeti jelenségeknél is megfigyelhető, például a hajnali harmatképződésnél. A túlhűtött vízgőz folyadékcseppeket formálva csapódik ki. A nagyon kis méretű vízcseppek gyorsan elpárolognak, azonban a kellően nagyok tovább növekedhetnek. kérdés (1,7 pont): Tegyük föl, hogy este C hőmérsékleten a levegőben levő vízgőz telített, és hajnalra a környezet hőmérséklete kismértékben, C-kal csökken. Feltételezve, hogy a pára nyomása nem változik, becsüld meg azt a minimális sugarat, amelynél nagyobb vízcseppek mérete növekszik. Használd a víz felületi feszültségének irodalmi értékét: N/m. A rész. Nem önfenntartó gázkisülés (4,8 pont). A feladatnak ebben a részében az úgynevezett nem önfenntartó gázkisülést tanulmányozzuk. Ahhoz, hogy folyamatos gázkisülés jöjjön létre, egy külső ionizálóra van szükség, amely térfogat- és időegységenként darab egyszeresen ionizált ionból és szabad elektronból álló párt hoz létre. Amikor a külső ionizálót bekapcsoljuk, az elektronok és ionok száma nőni kezd. Az elektron- és ionsűrűség határtalan növekedésének a rekombináció szab gátat: ebben a folyamatban egy szabad elektron és egy ion semleges atommá rekombinálódik. A térfogat- és időegységenként lejátszódó rekombinációk számát a következő kifejezés adja meg: Tegyük fel, hogy a külső ionizálót a pillanatban kapcsoljuk be, és ekkor az elektronok és az ionok kezdeti sűrűsége egyaránt nulla. Ezután az elektronok sűrűsége a idő függvényében a következőképp változik: kérdés (1,8 pont): Határozd meg és fejezd ki , , értékét és függvényében. Tegyük fel, hogy két külső ionizálónk van. Ha csak az egyiket kapcsoljuk be, az elektronsűrűség a gázban egyensúlyi értéket ér el. Ha csak a másikat kapcsoljuk be, akkor viszont az egyensúlyi elektronsűrűség . kérdés (0,6 pont): Határozd meg a gázban kialakuló egyensúlyi elektronsűrűséget, ha egyszerre mindkét külső ionizálót bekapcsoljuk. Figyelem! A következőkben feltételezzük, hogy a külső ionizáló hosszú ideje be van kapcsolva, a folyamatok stacionáriussá váltak, és nem függenek az időtől. A töltéshordozók által keltett elektromos teret hagyd teljesen figyelmen kívül. Tegyük fel, hogy a gáz egy csőben van két párhuzamos, területű vezető lemez között, melyek távolsága egymástól . A lemezek közé kapcsolt feszültség elektromos teret hoz létre. Tegyük fel, hogy mindkét fajta töltéshordozó sűrűsége közel állandó a csőben. Tegyük fel, hogy az elektronok (jelöljük e indexszel) és az ionok (jelöljük i indexszel) is ugyanakkora rendezett sebességre tesznek szert az elektromos tér hatására: kérdés (1,7 pont): Fejezd ki a csőben folyó elektromos áramot , , , , , és az elemi töltés függvényében. kérdés (0,7 pont): Határozd meg és fejezd ki a gáz fajlagos ellenállását , , , és függvényében kellően kicsi feszültség esetén. B rész. Önfenntartó gázkisülés (5,2 pont). A feladatnak ebben a részében az önfenntartó gázkisüléssel foglalkozunk, és megmutatjuk, hogyan válik a csőben az áram önfenntartóvá. Figyelem! A következő részben a külső ionizálás ugyanazzal a ionizációs rátával működik tovább. Hanyagold el a töltéshordozók által keltett elektromos teret, így az elektromos tér homogén a csőben. Ezen kívül a rekombináció is teljesen elhanyagolható. Az önfenntartó gázkisülésben van két fontos folyamat, amit eddig nem vettünk figyelembe. Az első folyamat a szekunder elektronok kibocsátása, a második pedig az elektronlavinák kialakulása. A szekunder elektron kibocsátás akkor történik, ha ionok ütköznek a negatív elektródnak (katód), és a kilökött elektronok a pozitív elektród (anód) felé mozognak. Az egységnyi idő alatt kilökött elektronok számának és az egységnyi idő alatt a katódba csapódó ionok számának aránya a szekunder elektron kibocsátási együttható: Az elektron-lavinák kialakulását a következőképp magyarázhatjuk. Az elektromos tér felgyorsítja az elektronokat, melyek mozgási energiája elég nagy lesz ahhoz, hogy ütközéskor újabb atomokat ionizáljanak. Ennek következtében jelentősen megnő az anód felé haladó szabad elektronok száma. Ezt a jelenséget az Townsend-együtthatóval írjuk le, ami megadja az elektronok számának növekedését miközben elektron áthalad távolságon: A teljes áram a cső bármely keresztmetszetén az ionáramból és az elektronáramból áll, melyek állandósult állapotban függenek a 5. ábrán látható koordinátától. Az elektronáram az tengely mentén a következőképp változik: 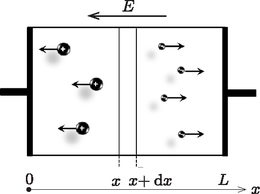 5. ábra kérdés (2 pont): Határozd meg és fejezd ki , értékét , , , és függvényében. Az ionáram az tengely mentén a következő kifejezés szerint változik: kérdés (0,6 pont): Határozd meg és fejezd ki , értékét , , , , és függvényében. kérdés (0,3 pont): Add meg az -re vonatkozó peremfeltételt, ha . kérdés (0,6 pont): Add meg az -re és -re vonatkozó peremfeltételt, ha . kérdés (1,2 pont): Határozd meg és fejezd ki az teljes áram értékét , , , , és függvényében. Tedd fel, hogy ez az érték véges marad. Legyen az Townsend-együttható állandó. Ha a cső hossza nagyobbá válik, mint egy kritikus érték, azaz , a külső ionizálás kikapcsolható, és a kisülés önfenntartóvá válik. kérdés (0,5 pont): Határozd meg és fejezd ki értékét , , , , és függvényében. 1A hivatalos megoldást és a mérési feladatokat a KöMaL novemberi számában ismertetjük. A feladatok kidolgozására 5 óra állt rendelkezésre. A három elméleti feladatra összesen 30 pontot lehetett kapni. A részfeladatok után közölt pontszámok az egyes kérdések nehézségi fokára utalnak.Ez a feladat 3 független részből áll. |