| Cím: | A vízgőz adiabatái | ||
| Szerző(k): | Radnai Gyula | ||
| Füzet: | 2011/szeptember, 372 - 374. oldal |  PDF | MathML PDF | MathML |
|
| Témakör(ök): | Szakmai cikkek | ||
|
A szöveg csak Firefox böngészőben jelenik meg helyesen. Használja a fenti PDF file-ra mutató link-et a letöltésre. A P. 4333. feladat megoldása kapcsán több versenyzőben is felmerült a gondolat: milyen függvénnyel írhatók le a reális anyagok adiabatái? Azt is tudjuk, hogy a lehetetlen folyamat helyett egy ,,vízszintes'' szakasz jelenik meg a diagramon, amely folytonosan, de töréssel csatlakozik az izoterma ívekhez. A vízszintes izoterma mentén halmazállapot-változáson (fázisátalakuláson) megy át a reális anyag. Van der Waals-közelítésben az adiabata: Ami a vízgőz izotermákat illeti, ezek a koordináta-rendszerben valóban olyanok, amilyennek sejtettük: lecsapódás közben , ha ; míg a száraz (vízcseppeket nem tartalmazó) gőz izotermája eléggé hasonlít az ideális gáz izotermájához: jó közelítésben Hogyan néznek ki a vízgőz adiabaták? Induljunk ki a száraz gőz állapotból! A mérések szerint az ilyen vízgőz adiabatának az egyenlete: Az izoterma az 1. ábrán -val jelölt állapot elérése után a kétfázisú tartományban vízszintesen folytatódik tovább. De hogyan folytatódik az adiabata? 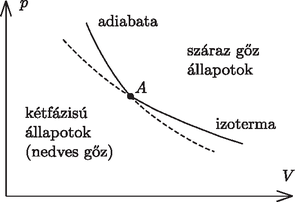 A mérések szerint a száraz gőz adiabatájának a folytatása a kétfázisú tartományban is függvénnyel közelíthető, ahol azonban . Ebből következik, hogy a kétfázisú tartományt ,,jobbról'' határoló görbe még ennél is ,,lankásabb'' kell, hogy legyen. Már csak az a kérdés, hogy ha a kétfázisú tartományban bárhol felveszünk egy pontot (kijelölünk egy állapotot) és ebből kezdjük adiabatikusan tágítani a rendszert, akkor találunk-e jól közelítő ,,adiabatikus függvényt''. A mérések szerint ezt az adiabatát egy olyan függvény közelíti legjobban, ahol Itt jelenti a vízgőz tömegének az össztömeghez viszonyított kezdeti arányát (2. ábra). (Az 1. ábrán látható pontban, mivel ez határpont, ahol a teljes rendszer vízgőzből áll, . Így adódik az ottani -ös kitevő.) 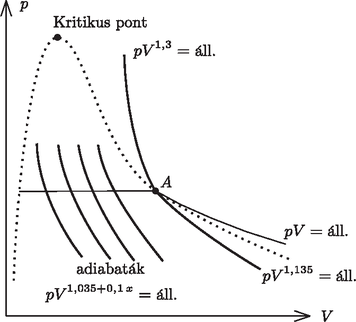 2. ábra Felhasznált irodalom
|