| Cím: | A gázmolekulák közepes szabad úthossza | ||
| Szerző(k): | Légrádi Imre | ||
| Füzet: | 1989/január, 33 - 35. oldal |  PDF | MathML PDF | MathML |
|
| Témakör(ök): | Szakmai cikkek | ||
|
A szöveg csak Firefox böngészőben jelenik meg helyesen. Használja a fenti PDF file-ra mutató link-et a letöltésre. Gázt tartalmazó edényben a molekulák rendszertelenül, de szakadatlanul ütköznek egymással. Azt a közepes távolságot, amelyet egy-egy molekula két ütközés között megtehet, a molekula közepes szabad úthosszának nevezzük. Ez függ a gáz állapotától. Tekintsünk egy homogén, azonos molekulákból álló gázteret. Tegyük fel ideiglenesen, hogy a gáztér minden molekulája áll, kivéve egyet, amelynek sorsát most megfigyeljük. Legyenek a molekulák átmérőjű gömbök. A mozgó molekula akkor ütközik egy állóba, ha a középpontjára illeszkedő és sebességvektorával párhuzamos egyenesnek az álló molekula középpontjától mért távolsága kisebb -nél. A mozgó molekula középpontja az ütközések következtében egy zegzugos, egyenes szakaszokból álló vonalon halad. Ha e köré a töröttvonal köré végig átmérőjű hengert képzelünk, akkor láthatjuk, hogy a mozgó molekula időegység alatt megtett útja során ütközni fog mindazokkal az álló molekulákkal, amelyeknek a középpontja a henger belsejébe esik. Ha a molekulák sűrűsége a térben , akkor a mozgó molekula által időegység alatt befutott hengerben molekula van, tehát időegység alatt ennyi ütközésben vesz részt, azaz Mivel azonban a valóságban a többi molekula is mozog, ezért az imént egyedül mozgónak tekintett molekula sebességének a többi molekulához mért relatív sebességét kell számítanunk. 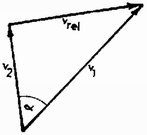 Két, összeütközés pillanatában lévő molekulát tekintve, legyen sebességük , ill. az ábra szerint. Ekkor az első molekula relatív sebessége a másodikhoz viszonyítva vektorkivonással kapható. Nagysága a koszinusztételből adódik: A relatív sebesség négyzetének átlaga a jobb oldal átlagainak összege. Mivel az összes molekula sebességének négyzetes középértéke ugyanaz, ezért Meg kell jegyeznünk, hogy a molekulák átmérője a valóságban nem fix érték. Függ az ütköző molekulák mozgási energiájától, vagyis a hőmérséklettől. A számításba veendő átmérőt effektív átmérőnek nevezzük. Ha a állapotegyenletből kifejezzük a molekulasűrűséget, akkor látjuk, hogy állandó hőmérsékleten a közepes szabad úthossz fordítottan arányos a gáz nyomásával. A közepes szabad úthossznak és a gázt tartalmazó edény karakterisztikus hosszméretének a viszonya jellemzi az edényben kialakított vákuum minőségét. A vákuum fogalma tehát relatív fogalom. Három vákuumszintről szokás beszélni: Nagyvákuumról (magasvákuum), ha a közepes szabad úthossz jóval nagyobb az edény karakterisztikus méreténél. (Karakterisztikus hossznak azt a méretet tekintjük, amely valamilyen kísérlet szempontjából figyelembe veendő hosszmérete az evakuált térrésznek.) Ilyenkor a gáz molekulái az edény falával ütközve, többször is befuthatják az edény karakterisztikus hosszát anélkül, hogy egymással ütköznének. Közepes vákuumról beszélünk, ha a közepes szabad úthossz megegyezik az edény karakterisztikus hosszával, vagy inkább kisebb annál. Kisvákuumról (alacsonyvákuum) van szó, ha a közepes szabad úthossz jóval kisebb az edény karakterisztikus hosszánál. Példaképpen számítsuk ki -os levegőre vonatkozólag a közepes szabad úthosszokat. A levegőt alkotó molekulák zömének effektív átmérője az adott hőmérsékleten . Tekintsük a következő nyomástartományokat, a szokásos méretű edények esetén: Az elmondottak szerint a molekulasűrűséget az állapotegyenletből kifejezve és a szabad úthossz összefüggésébe beírva: Ilyen értelemben például vákuum van egy porózus falú edény pórusaiban annak ellenére, hogy az edényt kitöltő gáz nyomása mondjuk, 1 bar. Ugyanis a pórusok átmérője néhányszor tíz nanométer, a normális nyomású levegőben a közepes szabad úthossz is kb. ugyanennyi, így a gáz molekulái többször is átmehetnek a pórusokon úgy, hogy csak a fallal ütköznek, egymással pedig nem. |