| Cím: | A termodinamika alapjai | ||
| Szerző(k): | Mihály László | ||
| Füzet: | 1977/január, 33 - 42. oldal |  PDF | MathML PDF | MathML |
|
| Témakör(ök): | Szakmai cikkek | ||
|
A szöveg csak Firefox böngészőben jelenik meg helyesen. Használja a fenti PDF file-ra mutató link-et a letöltésre. A természeti folyamatok leírására különböző törvényeket állíthatunk fel, amelyek segítségével megjósolhatók a törvények érvényességi körébe tartozó események. Szép példa erre a klasszikus mechanika, ahol már középiskolás szinten is matematikai tisztasággal tanulmányozható az alaptörvények mechanizmusa. Általános probléma azonban, hogy a folyamatokban résztvevő egységek számát növelve a matematikai nehézségek rohamosan növekszenek, és hamarosan a numerikus módszerek is csődöt mondanak. A klasszikus mechanikában bizonyított tétel például, hogy már három, egymással gravitációs kölcsönhatásban álló test mozgásegyenleteinek megoldása sem adható meg zárt formában. A kvantummechanikai többtestprobléma (pl. a hidrogénnél nehezebb atomok elektronszerkezetének megadása) szintén csak közelítőleg oldható meg. Még a legnagyobb számítógépek is ‐ amelyekkel egyes kristályszerkezetekben lezajló folyamatokat szimulálnak ‐ csak kb. 1000 atom szimultán mozgását tudják követni. Érdekes tény viszont, hogy ha egy rendszerben nagyon sok egyforma részecske van, akkor ismét találhatunk általános törvényszerűségeket, amelyek ugyan nem adják meg az egyes részecskék helyzetét és sebességét (a rendszer mikroszkopikus állapotát), de sok, számunkra érdekes kérdésre választ adnak. A fenomenologikus termodinamika tapasztalati tények alapján felállított kis számú axómia és a folyamatokban résztvevő anyagok ugyancsak tapasztalatból ismert állapotegyenlete segítségével meghatározza a rendszer makroszkopikus állapotát. A statisztikus fizika egyszerű alapfeltevésekből, pusztán a részecskék nagy számát és egyformaságát feltételezve bebizonyítja a termodinamika alaptörvényeit, és képes arra, hogy az egyes részecskék közötti mikroszkopikus kölcsönhatásból meghatározza az anyag állapotegyenletét. Az alábbiakban a fenomenologikus termodinamika alapjaival ismerkedünk meg, és a fogalmak megértéséhez szükséges szemléletes mikroszkopikus képet kaphatunk. I. A termodinamika tárgya. Állapotjelzők A termodinamika egy rendszer jellemzésére úgynevezett állapotjelzőket használ, amelyek közös vonása, hogy a rendszer makroszkopikus tulajdonságait írják le. (Nem állapotjelző pl. a rendszert alkotó részecskék térbeli helyzete; állapotjelző a rendszer térfogata, ami bizonyos értelemben az előbbi mennyiség átlagolásával kapható.) Állapotjelző csak olyan mennyiség lehet, amely független attól, hogy a rendszer egy korábbi állapotából milyen úton jutott az új állapotba. (Egy dugattyús hengerbe zárt gáz állapotjelzője lehet a dugattyú pillanatnyi távolsága a henger szemközti falától, de nem állapotjelző pl. a dugattyú által megtett út ‐ azaz az elmozdulások abszolút értékeinek összege.) 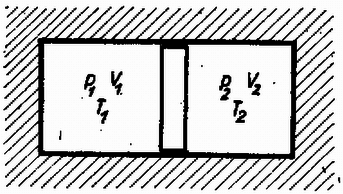 1. ábra A termodinamika mindig energiacserével kapcsolatos jelenségeket tárgyal, ezért állapotjelzőnek csak azokat a paramétereket nevezzük, amelyek az energiacserével kapcsolatosak. Ez a kapcsolat mindig Látható, hogy az állapotjelzők az utolsó kettő ( Az extenzív és intenzív állapotjelzők egy másik, ekvivalens definíciója: Ha egy egyensúlyban levő rendszert képzeletben két azonos részre osztunk, akkor az extenzív állapotjelzők (pl. térfogat) feleződnek, az intenzívek (pl. nyomás) pedig változatlanok maradnak. Az alábbiakban a termodinamikának azzal a részével foglalkozunk, amelynek célja egy zárt rendszer új egyensúlyi állapotának megkeresése, ha az eddigiekben tiltott energiacserélési formák közül néhányat megengedünk. (Zárt a rendszer, ha környezetével nem cserél energiát; egyensúlyban van, ha állapotjelzői nem változnak.) Az alapfeladat tehát olyan jellegű, mint az 1. ábrán látható példa: mi lesz az új egyensúlyi állapot, ha a falat hővezetővé tesszük? A probléma megoldása során bevezetett fogalmak később egyszerűen elvezetnek olyan mennyiségekhez is, mint a hőkapacitás, a hőtágulási együttható stb. Az utóbbi évtizedekben kifejlődött a termodinamikának egy olyan ága (az ún. irreverzibilis termodinamika), amely nemcsak a már beállt egyensúlyi állapotot képes megjósolni, hanem foglalkozik a folyamat időbeli lefolyásával is. Újabban már szokásos ezt az új, ún. irreverzibilis termodinamikát nevezni termodinamikának, míg a hagyományos termodinamikának (amellyel ez a cikk is foglalkozik) új nevet adtak; a termosztatikát. Várható, hogy a jövőben ezek az elnevezések válnak majd általánossá, mert a fizikai fogalmaknak valóban jobban megfelelnek. (Dr. Bodó Zalán) II. A termodinamika módszerei A fenti tárgykörben az anyag viselkedéséről szerzett ismereteinket a termodinamika főtételeibe sűrítettük. E tételek matematikai formába önthetők, és ezek képezik a továbbiakban mindig érvényes "játékszabályokat''. A rendszer állapotát maradéktalanul leíró állapotjelzők értékének függvényében a többi állapotjelző kifejezhető. Az állapotjelzők közötti kapcsolat a vizsgált rendszerre jellemző, és matematikai formája az állapotegyenlet. Az anyag állapotegyenleteit méréssel vagy elméleti úton a statisztikus fizika módszereivel határozhatjuk meg. A keresett megoldást általában a főtételek, az állapotegyenletek és a meghatározandó mennyiség definíciójának összevetésével kaphatjuk meg. A továbbiakban először ismertetjük a főtételeket, majd néhány anyag állapotegyenleteit. Végül feladatokat közlünk, amelyek megoldásával az új ismeretek elmélyíthetők. III. Az első főtétel Kísérleti tapasztalat, hogy ha mérjük egy makroszkopikus rendszer teljes energiájának megváltozását, és meghatározzuk a rendszeren végzett munkák összegét A fenti axiómát az igazolja, hogy a belőle később levezetett összefüggések a tapasztalattal összevetve igaznak bizonyulnak. Ha valaki mégis magyarázatot igényel, akkor a termodinamika kereteiből kilépve a következő szemléletes mikroszkopikus kép adható. A rendszer részecskéinek mozgása két részre bontható: egy rendezett, kollektív mozgásra és az ettől való eltérésre. Normális méretekben csak az első figyelhető meg, pl. amikor egy rugó  2. ábra Természetesen lehetséges olyan változás, amelynek során csak a rendezett mozgás módosul, és ezt a szokásos állapotjelzők Fontos megjegyezni, hogy mivel a rendszer energiája állapotjelző, de a rendszeren végzett munka nem az (mert ugyanabba az állapotba különböző módon eljutva a végzett munka más és más lehet), a hőcsere sem állapotjelző, hanem a munkavégzéssel analóg fogalom. Ezért nincs értelme egy testben található "hőmennyiségről'' beszélni. (Ugyanúgy, mint ahogy nem beszélünk a testben levő munka mennyiségéről sem.) IV. A második főtétel Az első főtétel nem elégséges a rendszer egyensúlyi állapotának meghatározásához, másrészt megenged a tapasztalattal ellentmondó hőcserével kapcsolatos jelenségeket. Ezért további axiómák felállítása szükséges. Tapasztaljuk, hogy ha egy hőszigetelő fallal két részre osztott rendszerben a fal hőszigetelését megszüntetjük (pl. két vasdarabot összeérintünk), akkor általában energiaáramlás indul meg. Előre megmondhatjuk, hogy lesz-e energiacsere, ha mindkét részrendszerrel megfelelő módon azonos mennyiségű és minőségű gázt (gázhőmérőt) hozunk kapcsolatba, és összehasonlítjuk azok hőtágulását. A tágulás mértékét a vizsgált rendszer "melegségének'' (tapasztalati hőmérsékletnek) nevezzük. Azt, hogy erről a fogalomról egyáltalán beszélhetünk, hogy létezik, a termodinamika nulladik főtételének szokás nevezni. A második főtételnek több megfogalmazása van. Ezek közül az egyik: Hőközlés formájában történő energiacsere során a melegebb test energiája csökken, a hidegebbé nő. Ez szemléletes és egyszerű axiómia, de matematikailag nem kezelhető. Hasznosabb a másik, vele ekvivalens kijelentés: Létezik abszolút termodinamikai hőmérséklet Az utóbbi megfogalmazás kevésbé szemléletes, ezért az elsőből bizonyítjuk. A bizonyítás jellegzetesen termodinamikai gondolatmenet lesz, a valóságosaktól meglehetősen távoli fogalmakat használ, melyeket alább definiálunk. Hőtartálynak nevezzük azt a testet, melynek "melegsége'' akkor sem változik, ha hő formájában energiát ad le vagy vesz fel. Folyamat a test állapotában egymás után bekövetkező változások sorozata. Kvázisztatikus az a folyamat, melynél a vizsgált rendszer minden piIlanatban egyensúlyban van. Ezen azt kell érteni, hogy a változás ideje az egyensúly beálltához szükséges mikroszkopikus folyamatok időtartamához képest nagy. Nem kvázisztatikus folyamat pl. egy robbanás. A kvázisztatikus folyamat elképzelésére azért van szükség, hogy az állapotjelzők a folyamat egészére értelmezhetők legyenek. Reverzibilis az a kvázisztatikus folyamat, amelynek bármely pillanatában az állapotjelzők egész kis megváltoztatásával a folyamat ellenkező irányúvá tehető. Nem minden kvázisztatikus folyamat reverzibilis. A reverzibilis folyamatok nagy szerepet játszhatnak egyes gondolatmenetekben, de kitüntetett voltuk nem jelenti azt, hogy a termodinamika nem érvényes, ha a folyamatok nem reverzibilisek. Egyszerűen arról van szó, hogy pl. egy gáztömeg robbanásszerű kiterjedésénél módszereinkkel csak a kezdeti és végállapot határozható meg, a közbenső állapotok nem. További speciális folyamatok: Izotermikus: az anyag "melegsége'' nem változik. Adiabatikus: a rendszer a folyamat során energiát hő formájában nem kap. Izobár: állandó nyomáson végbemenő folyamat. Izochor: állandó térfogaton végbemenő folyamat. Körfolyamat, amelynek végén az anyag visszajut eredeti állapotába. Carnot-körfolyamat: olyan reverzibilis körfolyamat, amely izotermikus és adiabatikus állapotváltozásokból áll. Első szakaszában a rendszer egy A kvázisztatikus folyamatok ‐ így a Carnot-körfolyamat is ‐ nagyon jól szemléltethetők egy síkon, melynek minden pontja a rendszer egy állapotának felel meg. A kapott ábra természetesen függ attól, hogy a folyamatot milyen anyagon hajtjuk végre. 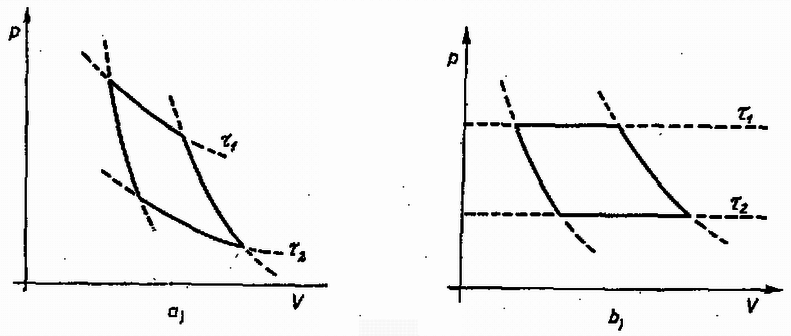 3. ábra A 3. ábrán feltüntettünk két Carnot-körfolyamatot a) ideális gázzal, b) fotongázzal. A görbék meghatározásánál az áIlapotegyenleteket használtuk fel, ezekről később lesz szó. Hatásfok. Ha a Carnot-körfolyamatot gázzal végezzük, akkor nyilvánvaló, hogy a körfolyamat végén munkát nyerhetünk, ha a gáz nagyobb melegségű (és nyomású) állapotban tágul és kisebb melegségű (és nyomású) állapotban nyomódik össze. Általában tetszőleges anyag esetén a hatásfok azt mutatja meg, hogy a körfolyamat során a hőközléssel felvett energia hányadrésze távozik mint mechanikai munka: A fenti fogalmak felhasználásával először azt bizonyítjuk be, hogy minden Carnot-körfolyamat hatásfoka azonos, ha Vegyünk két Carnot-gépet (különböző anyagokkal töltve), melyeket egy nagyobb 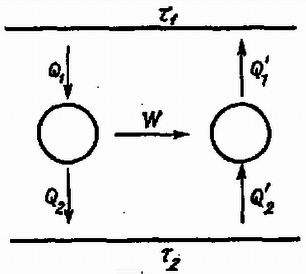 4. ábra Az első főtételből következik, hogy
Ha a Carnot-gép hatásfoka nem függ a belehelyezett anyagtól, akkor csak a hőtartályok termodinamikai állapotától függhet. Abszolút hőmérsékletnek nevezzük azt a mennyiséget, amelyet úgy kapunk, hogy a vizsgált testet és a hőmérséklet-etalon hőtartályt (a hőmérséklet méréséhez ugyanúgy kell etalon, mint a távolság vagy tömeg méréséhez) bármilyen Carnot-géppel összekötve, a körfolyamat hatásfokából képezzük a mennyiséget. ( A hőmérséklet ismeretében keressük meg a hozzá tartozó extenzív állapotjelzőt! Rendeljük a rendszer egy adott állapotához az Bizonyítjuk, hogy a fenti módon definiált mennyiség állapotjelző, azaz értéke független attól, hogy a rendszer milyen módon jut új állapotába. Ha először izotermikusan, azután adiabatikusan jutunk az új állapotba, akkor A definícióból látható, hogy a hőközlés A második főtétel első megfogalmazásából és az entrópia definíciójából egyszerűen bizonyítható az entrópianövekedés tétele is. Említettük, hogy a hőközlés a mikroszkopikus képben a rendezetlen mozgásban bekövetkezett változással jár együtt. Másrészt láthattuk, hogy az entrópiaváltozás és a hőközlés között szigorú termodinamikai kapcsolat van. Ebből következik, hogy az entrópia valamilyen módon a mikrorészecskék rendezetlenségére jellemző szám. Az entrópianövekedés tétele egyszerűen azt fejezi ki, hogy a részecskék rendezetlen mozgása önmagától nem alakul rendezetté. V. A harmadik főtétel Az entrópia fenti definíciójában csak az entrópia változását rögzítettük le, az abszolút érték egy additív állandó erejéig határozatlan maradt. A harmadik főtétel az entrópiát egyértelművé teszi azzal, hogy kimondja: Minden rendszer entrópiája tart nullához, ha hőmérsékletével nullához tartunk. Az állítást azért kell ilyen óvatosan fogalmazni, mert ebből a tételből bizonyítható, hogy az anyagokat nem lehet VI. Állapotegyenletek Az ideális gáz állapotegyenleteivel már megismerkedtünk. További két egyszerű példa adható: Fotongáz: ahol Nagy hőmérsékleten, ha Az állapotegyenletek szintén szemléltethetők az állapotsíkon (5., 6. ábra). 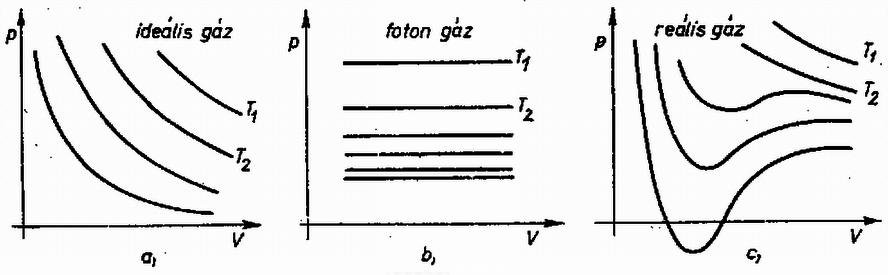 5. ábra 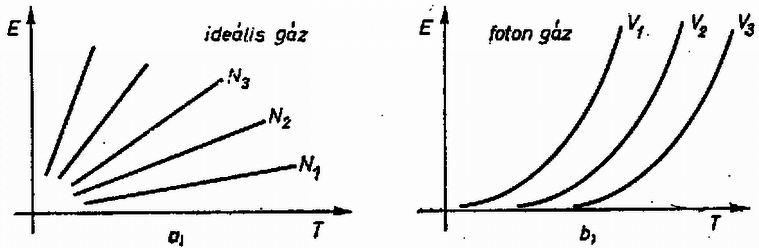 6. ábra A főtételek felhasználásával az anyag állapotegyenletei egy egyenletbe foglalhatók össze. Ez az egyenlet ‐ az úgynevezett fundamentális egyenlet ‐ egyszerű esetben egy A fenti tétel illusztrálására lássunk két példát! Ideális gáznál ( ez pedig valóban a két állapotegyenlet átrendezett alakja. Fotongáznál: Láthatjuk, hogy az entrópiafüggvény létezésének (vagyis tulajdonképpen a második főtételnek) az a következménye, hogy egy anyag állapotegyenletei nem teljesen függetlenek, mert ugyanannak a függvénynek különböző változó szerinti deriváltjai. VII. Feladatok Az első főtétel alkalmazása 1. Határozzuk meg az ideális gáz egy molekulájára fajhőjét, azaz a Megoldás. a) b) c) 2. Határozzuk meg Megoldás. A második főtétel, entrópia 3. Mekkora lehet egy fűtőtest optimális hatásfoka? (A közönséges hősugárzó hatásfoka 4. Bizonyítsuk be, hogy a sötétebb testek a sugárzó hőt nemcsak könnyebben nyelik el, hanem könnyebben ki is sugározzák! 5. Egy szilárd test fajhője általában jó közelítéssel állandó, vagyis igaz a Megoldás. A második feltevésből következik, hogy 6. Az előző feladat eredményeit felhasználva mutassuk meg, hogy ha egy zárt rendszerben Megoldás. A réz entrópiája csökken: A harmadik főtétel 7. Bizonyítsuk be, hogy az ideális gáz állapotegyenlete |