|
A szöveg csak Firefox böngészőben jelenik meg helyesen. Használja a fenti PDF file-ra mutató link-et a letöltésre. Az izotermális változással kapcsolatban egy körfolyamatot ismertünk meg amely számunkra munkavégzéssel jár, és igen sokszor megismételhető. Miről is volt szó? Egy igen nagy, meleg tartály molekuláinak mozgási energiájából munkavégzés lett, de ugyanekkor a meleg tartályból eltávozott mozgási energia nagy részét megkapták a hideg tartály molekulái. A hengerbe bezárt 4 gramm héliumgáz pontosan ugyanabba az állapotba került vissza, mint amilyenben a kísérlet elején volt. A gyakorlat céljából az a lényeges, hogy a meleg tartály molekuláinak mozgási energiájában beállt veszteséget teljes egészében tüzelőanyagaink elégetésével kell biztosítanunk, és ebből számunkra csak az a hányad értékes, amely a súlyt magasabbra vitte, vagyis munkát végzett. A hideg tartályba került mozgási energiát alig tudjuk hasznosítani. Ezért számítottuk ki a példánkban a lehetőleg minél célszerűbben, gondosabban vezetett körfolyamat hatásfokát, és ezt -nek találtuk.
Gondolatmenetünkben eddig még nem fordult elő a hőmennyiség fogalma. Képzeljük el a következőt. Dörzsöljünk (vékonyfalú edényben) 1 kg vizet, illetve 1 kg alumíniumot, 1 kg vasat stb. Ilyenkor azt mutatják a kísérletek, hogy 427 mkp munkavégzés árán a víz 1 C-kal, az alumínium C-kal, a vas C-kal lett melegebb. Nyilván a dörzsölés 427 mkp munkavégzése árán ezen anyagokban növekedett a molekulák, atomok mozgási energiája. A melegedés nagysága független a kísérlet körülményeitől, a felületektől stb. Ha 1 kg C hőmérsékletű vizet és 1 kg C hőmérsékletű alumíniumot hozunk össze egy termoszban, akkor 2 kg C hőmérsékletű anyagot kapunk, vagyis a víz molekulái mozgási energiát adtak át az alumínium atomjainak (ionjainak, elektronjainak).
A szokásos fogalmazás szerint, ha tömegű test hőmérséklete fokról -re emelkedik, akkor azt mondjuk, hogy hőmennyiséget vett fel ( fajhő víznél , alumíniumnál 0,22cal/g∘C, vasnál 0,11cal/g∘C). A hőmennyiség fogalma ennyiből egy praktikus szorzat, mint például a munka vagy a forgatónyomaték.
A hőmennyiségekkel végzett kísérletek egyik része azt mutatja, hogy hideg és meleg anyagok keveredésekor az egyik anyag által leadott kalóriák száma egyezik a másik által felvett kalóriák számával. Természetesen csak akkor, ha mindössze a hőmérsékletek kiegyenlítődése megy végbe. Nem érvényes a kalóriákra vonatkozó keverési szabály, ha például meleg nátriumot keverünk hideg vízzel, ha hideg léggömböt öntünk le forró vízzel, és a kiterjedéskor munkavégzés van stb. Abban az igen számos kísérletben, amikor az érintkező testeknek csak a hőmérséklete változik meg, a felvett kalóriák száma arányos a molekulák, atomok stb. mozgási energia növekedésével.
A hőmennyiségekkel végzett kísérletek másik része azt mutatta, hogy minden testnél, a legkülönbözőbb körülmények között is 427 mkp munkavégzés 1 kcal hőmennyiséget eredményez. Ez a tapasztalat érvényesnek bizonyult minden olyan (igen számos) esetben, amikor a súrlódásos, a rugalmatlan ütközéssel együtt járó munkavégzést semmi más jelenség nem kíséri, mint a testek hőmérsékletének emelkedése. (Nem érvényes például, ha gyufafejet dörzsölünk stb.) Ilyen megfigyelések tárták fel azt a tényt, hogy súrlódáskor, rugalmatlan ütközésnél az elvégzett mechanikai munka szétoszlik az anyag részecskéi között mint mozgási energia, ami a hőmérséklet emelkedésében nyilvánul meg.
A termodinamika I. főtétele néven említett törvény az energia megmaradásának tényét fejezi ki, az általunk felsorolt hőtani példákban úgy, hogy minden 427 mkp mechanikailag elvégzett munka mint 1 kcal hőmennyiség felvétele jelentkezik. Későbbi tapasztalatok az energia megmaradási törvényét érvényesnek találták minden energiafajra. Képzeljük el a természetnek egy olyan részét, amely úgy van elkülönítve a többitől, hogy semmiféle hatást sem fejtenek ki a belül levő anyagok a kívül levőkre. Ez az ún. zárt rendszer. (Nem is olyan könnyű megállapítani, hogy egy térrészünk, dobozunk zárt rendszer-e; például rádióadót nem szabad belehelyezni.) Ha van egy ilyen zárt rendszerünk, akkor benne az energiák összege állandó. Ha a zárt rendszerben valamely energiafajbeli energia csökken, akkor helyette más energiafajnak, fajoknak növekedését tapasztaljuk. Ha zárt rendszerünket egy elképzelt vagy valóságos fallal kettéválasztjuk, akkor az egyik rész energiacsökkenését a másik részben ugyanakkora növekedés kíséri, az energia átvándorolt.
Egy időben többen próbálkoztak perpetuum mobile feltalálásával. Ez a szerkezet olyan zárt rendszer lett volna, amely munkát végzett volna anélkül, hogy benne maradandó változás következett volna be. Több százra tehető az eredménytelen kísérletek száma. Az energiamegmaradás törvénye a perpetuum mobile lehetetlenségének elvét ezernyi, milliónyi más fizikai tapasztalattal, kísérleti eredménnyel kapcsolja össze. Ezek közvetve mind a perpetuum mobile lehetetlenségét jelentik, ami sokkal nagyobb bizonyosság, mint az, hogy ilyen gépet még senkinek sem sikerült összeállítani.
 1. ábra
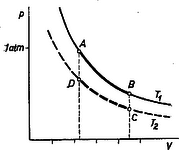
Térjünk vissza körfolyamatunkhoz (Lapunk 3. számában használt adatokkal, 1. ábra). A dugattyú kitolódásakor (A-tól B-ig) a meleg tartály molekuláinak mozgási energiájából 153 mkp súlyemelést, hasznos munkát végzett. De a dugattyú kitolódását úgy is elérhetnénk, hogy a meleg tartályba való bemártás helyett a henger külső felületét érdes lemezzel dörzsöljük úgy, hogy közben 153 mkp súrlódásos munkát végzünk. Ettől épp úgy feltolódna a 100 kp súlyú henger 1,53 m magasra, és a héliumgáz változatlan hőmérsékleten kiterjedne 22,4 literről 44,8 literre. Ha ezzel a 153 mkp munkával egy másik kísérletben 1 kg 0∘C-os vizet dörzsöltünk volna, ennek hőmérséklete 0,358∘-ra emelkedett volna, az 1 kg víz 1⋅0,358=0,358 kcal hőmennyiséget vett volna fel, a szokásos szóhasználat szerint. Ezért úgy is szokták mondani, hogy a hengerrel, tartállyal végzett eredeti kísérletünkben az izotermálisan kiterjedő héliumgáz 153:427=0,358 kcal hőmennyiséget vett fel a tartályból. Ugyanis az a mérnök, aki olaj elégetésével tartja állandó hőfokon a külső tartályt, ebből a 0,358 kcal adatból számítja ki, hogy mennyi tüzelőanyagot égessen el. A kiterjedési munkavégzést ezzel a képlettel számítottuk ki: | W1=2,24⋅T1273⋅2,3⋅lgVbVa, |
tehát az izotermális kiterjedés alkalmával a ,,felvett hőmennyiség'': | Q1=W1427=2,24427⋅T1273⋅2,3⋅lgVbVa=KT1. | (1) |
A héliumgázunk T2 fokon történő összenyomásakor 102 mkp munkát végez az 1,53 m magasról lesüllyedő 67 kp-os teher. Az előbbi szövegezéshez hasonlóan most azt mondhatjuk, hogy az izotermális összenyomáskor a hideg tartályba ,,leadott hőmennyiség'' 102:427=0,238 kcal. Kiszámítására ez a képlet alkalmas: | Q2=W2427=2,24427⋅T2273⋅2,3⋅lgVbVa=KT2. | (2) |
A mérnöki gyakorlatot valóban az érdekli, hogy mennyi hűtővízzel, mekkora kalóriaelvonással lehet a hideg tartályt állandóan ugyanazon az alacsony hőmérsékleten tartani.
A körfolyamat eredményeként kapott 153-102=51 mkp munkavégzésről ilyen értelemben azt szokták mondani, hogy a felvett 0,358 kcal-ból visszaadtunk 0,238 kcal-t, és a 0,358-0,238=0,120 kcal-ból lett 427⋅0,120=51 mkp munkavégzés. De ha így is mondjuk, a lényeg az, hogy a meleg tartályból eltávozott a molekulák 153 mkp mozgási energiája, belőle hasznos munkavégzéssé lett 51 mkp, és 102 mkp-ot a hideg tartály molekulái kaptak meg mozgási energiájuk növelésére.
Az előző cikkben körfolyamatunk hatásfokára az | η=W1-W2W1=T1-T2T1=1-T2/T1 | (3) |
kifejezést kaptuk. (1) és (2) alapján, mivel T és Q arányosak: Ne felejtsük el, hogy Q1 ,,hőmennyiség'' tulajdonképp azt a mozgási energiát jelenti, amely eredetileg a meleg tartály molekuláinak rendezetlen mozgásában volt meg, de a kiterjedés végén mint egy nagy tömeg meghatározott irányban történt emelésének munkája jelentkezett. Hasonlóan Q2 ,,hőmennyiség'' olyan munkavégzés, amelyet a lesüllyedő nagy teher szórt szét mozgási energiaként a hideg tartály molekulái között.
Az ún. termodinamika a múlt században a gőzgép feltalálása után született meg. W1 (illetőleg Q1=W1/427) a tüzelőanyagok elégetésével fedezendő. Tudjuk, hogy az energia nem vész el, de ha hőerőgépről van szó, számunkra csak a mechanikai munkává alakuló W1-W2 értékes. A (3) által adott hatásfok elég rossz, például T1=273∘K, T2=182∘K esetében η=0,33=33%, vagy T1=373∘K=100∘C és T2=273∘K=0∘C esetében η=0,27=27%. Egészen természetes, hogy vizsgálni kezdték, nem javítható-e ez a hatásfok? Talán más dolgozó anyaggal, nem az ideális gázként szereplő héliummal vagy másfajta körfolyamattal jobb hatásfokot érhetnénk el? Az egyik eljárás az lehetne, hogy kísérletekkel megvizsgálunk minél több dolgozó anyagot, körfolyamatot, hátha egyszer találunk olyat, amely jobb hatásfokú. De úgy, mint az I. főtételnél, most is bölcsebb, ha a kérdést egyéb jelenségekkel kapcsolatba hozva mélyebben vizsgáljuk meg.
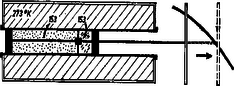
Megpróbálkozunk azzal, hogy a (3) által megadottnál jobb hatásfokú körfolyamatot találjunk. Kísérleti eszközünk 273∘K hőmérsékletű tartályban egy kettős henger (2. ábra).
  2. ábra
Bal oldali részében 4 gramm héliumgáz van 44,8 liter térfogaton. Ha ez a dugattyú 2,24 méteres jobbra történő mozgásával 22,4 literre nyomódik össze, a tartály molekuláinak 153 mkp mozgási energiát adunk át. A jobb oldali hengerbe tesszük a megvizsgálandó anyagot (nemideális gáz, rugók, gumiszivacs stb.), mégpedig pontosan annyit, amennyinek 2,24 méteres úton történő kiterjedése 153 mkp munkavégzést ad. A jobb oldali hengerbe tett anyag mennyiségének alkalmas megválasztásával ez biztosan megtehető. A két dugattyú közös rúdon van, amely egyetlen gereblyét tol ki lejtőnk mellett. Adataink olyanok, hogy a kettős dugattyús rúd gyakorlatilag munkavégzés nélkül teszi meg útját jobb felé. A 273∘K hőmérsékletű tartály molekuláival semmi sem történik, hiszen 153 mkp mozgási energiát kapnak a héliumgáztól, de 153 mkp mozgási energiát adnak a jobb oldali hengerben levő anyagnak. A gereblye teher nélkül jár.
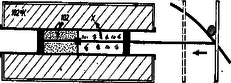
Ezután kicseréljük a tartályt 182∘K hőmérsékletű tartályra, és a héliumgázt kiterjesztjük eredeti 44,8 literes térfogatára (alsó rajz). Eközben, amint tudjuk, a héliumgáz 102 mkp mozgási energiát kap a tartálytól. Egyszersmind a megvizsgálandó anyag összenyomódik eredeti térfogatára, és a hideg tartálynak (a hideg tartály molekuláinak) valamilyen x mkp mozgási energiát ad át. A megvizsgálandó anyag is egy körfolyamatot csinált végig. Elvben, a priori három eset gondolható el.
x>102 mkp. Minthogy x a megvizsgálandó anyag W2-je, ez azt jelenti, hogy a megvizsgálandó anyag hatásfoka rosszabb, mint amit (3) ad meg. A gereblyét nekünk kell erővel húzni, hogy megtegye útját bal felé. Ez bizony megeshet.
x=102 mkp. Megvizsgálandó anyagunk számára a hatásfok ugyanannyi, mint a héliumgázé. Még mindig nem találtunk a (3) által megoldottnál jobb hatásfokot. A gereblye gyakorlatilag munkavégzés nélkül mozgott.
x<102 mkp, például x=86,7 mkp. Ekkor ebben a második izotermális lépésben a hideg tartály molekulái kevesebb mozgási energiát (,,hőt'') kapnak vissza a megvizsgálandó anyagtól, mint amennyit adnak a héliumgáznak. A hideg tartály molekuláinak összes energiájában hiány áll be, példánkban 102-86,7=15,3 mkp. Ugyanakkor a gereblye 10 kp terhet képes 1,53 méter magasra feltolni, tehát mechanikai munkavégzés történt. Most a megvizsgálandó anyag jobb hatásfokkal dolgozott, mint a (3) által megadott érték. De jól gondoljuk végig, mivel járna ez az eset.
Ebben a harmadik feltételezett esetünkben, amikor x<102 mkp, a héliumgáz és a megvizsgálandó anyag körfolyamatot csináltak végig. A meleg tartály is pontosan eredeti állapotában maradt. Az egyetlen, ami történt: a hideg tartályból eltűnt a molekuláinak 15,3 mkp mozgási energiája (a gyakori szóhasználat szerint 15,3:427=0,0358 kcal ,,hő''), és végbement 15,3 mkp mechanikai munkavégzés. Ha szigorúan vesszük, a hideg tartálynak egy kicsit le kell hűlnie, hacsak a mérnök megfelelő olajmennyiség elégetésével be nem ad neki 0,0358 kcal-t. Azonban a természetben sohasem tapasztalunk olyat, hogy egy anyag lehűljön, és anélkül, hogy egyéb anyagokban bármilyen változás történne, molekuláinak mozgási energiavesztesége teljes egészében mint munkavégzés jelentkezne. Másként elmondva, az olaj elégetése által adott 0,0358 kcal teljes egészében munkává alakulna. Ezért mondjuk: az x<102 mkp eset a természetben nem fordul elő, egyetlen anyag körfolyamatának hatásfoka sem lehet jobb, mint amit (3) megad. Ezt a törvényt nevezik a termodinamika II. főtételének.
Figyeljük meg, hogy eljárásunk ugyanolyan, mint az I. főtételnél. Egyenes úton megfigyelni, hogy a hatásfok lehet-e jobb, mint a (3) szerinti, elég ritkán elvégzett, kényelmetlen kísérleti feladat. De a hatásfok-vizsgálatot összekapcsoltuk egyéb, gyakrabban, könnyebben megfigyelhető folyamattal (lesz-e a ,,hő''-ből teljes egészében munkavégzés), és így az állítás ellenőrzésének körét, hitelességét igen nagy mértékben kiterjesztettük.
Néhány kiegészítő megjegyzés. A (3) alatti hatásfok a remélhető legfelső határt jelenti, mert tökéletlenül vezetett körfolyamatban súrlódás, dugattyúütközés rontja a hatásfokot. A valóságban a körfolyamat tökéletes vezetése kivihetetlen. Hőerőművek hatásfokát a lehűlési veszteségeken kívül különösen az rontja, hogy a vízből forralással kell gőzt készíteni, és be kell adni a nagy párolgási hőt. Szigorúan véve körfolyamatunk nem-izotermális szakaszait is meg kellene vizsgálnunk; az eredmény ugyanaz.
Gondolatmenetünk bemutatta a II. főtétel jelentését bármely anyag esetében, de csak izotermális körfolyamat mellett. Hátra van a hatásfok megvizsgálása tetszésszerinti körfolyamatok esetében.
|
 PDF | MathML
PDF | MathML 

