| Cím: | Az izotermális változás | ||
| Szerző(k): | Vermes Miklós | ||
| Füzet: | 1969/március, 129 - 132. oldal |  PDF | MathML PDF | MathML |
|
| Témakör(ök): | Szakmai cikkek, Izotermikus állapotváltozás (Boyle--Mariotte-törvény) | ||
|
A szöveg csak Firefox böngészőben jelenik meg helyesen. Használja a fenti PDF file-ra mutató link-et a letöltésre. Ez alkalommal a hőtan (termodinamika) egyik alapvető fogalmával, az izotermális változással foglalkozunk. Izotermális változásnak nevezünk olyan kísérletet, amelynek folyamán a hőmérséklet állandó marad. Lássunk erre egy példát. 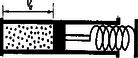 1. ábra Legyen a hőmérséklet , tehát a gáz nyomása atmoszféra (közelítően ). A dugattyún kívül légüres tér van, tehát a dugattyút egy erős rugóval, 0 kp erővel kell tartani ebben a helyzetében. Belülről azért nyomja a gáz a dugattyút, mert nagy sebességgel repülő molekulái beleütköznek. Most hajtsunk végre a gramm héliummal egy izotermális folyamatot. Ez azt jelenti, hogy nyomását, térfogatát megváltoztatjuk, de úgy, hogy hőmérséklete közben állandó maradjon. Egy kissé lazítunk a rugón és a dugattyú elindul kifelé. Eközben a nyomás csökken, a térfogat nagyobbodik. De ha tényleg elvégezzük a kísérletet, akkor azt tapasztaljuk, hogy a hőmérséklet nem marad állandó, mert a dugattyút lökő molekulák átlagsebessége és ezzel a gáz hőmérséklete csökken. A molekulák a kifelé menő dugattyúról kisebb sebességgel pattannak vissza, mint amekkorával neki ütődtek, és mozgási energiájuk csökkenése egyenlő a kifelé haladó dugattyú által végzett munkával. Azonban az a szándékunk, hogy a változás izotermális legyen, a hőmérséklet maradjon állandó (2. ábra). 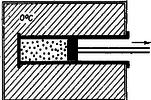 2. ábra A hengert egy óriási méretű, hőmérsékletű tengervízzel telt tartályba dugjuk be. Hengerünk fala vörösrézből készült. Ennek az anyagnak az a tulajdonsága, hogy két oldalán a molekulák mozgási energiája csak egyenlő lehet (jó ,,hővezető''). Tehát amint a dugattyú kifelé halad, a falon át molekulái mozgási energiát kapnak a hőtartály anyagából, átlagos sebességük, a hélium hőmérséklete állandó marad és megvalósítottuk az izotermális folyamatot. Ha szigorúan vesszük, a hőtartálynak kissé le kell hűlnie, de mi ettől eltekinthetünk. Szóval izotermális változásunk alkalmával az állandó hőmérsékletű héliumgáz kiterjed, például literről literre. Eközben munkát végez. Ezt a munkát szeretnénk kiszámítani. Nem is olyan könnyű feladat, hiszen kiterjedés közben csökken a nyomás, a térfogattal fordítva arányosan, és érvényes a gáztörvény. Ezt az összefüggést a koordinátarendszerben hiperbola tünteti fel (a 3. ábra vastag vonala). 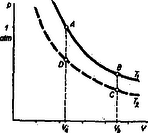 3. ábra De nemcsak kiszámítani, hanem hasznosítani is szeretnénk ezt a munkát, mégpedig úgy, hogy súrlódásmentes dugattyúnk lassan mozogjon, különben útjának végén odacsapódik a megállító akadályhoz és energiájának egy része kárba vész. Az izotermálisan kiterjedő gázzal következőképp végeztetünk munkát (4. ábra). 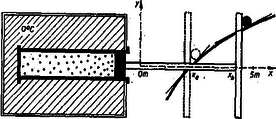 4. ábra Miközben a henger a hőmérsékletű tartályban van, a dugattyúról kinyúló rúd függőleges, gereblyeszerű végződésével egy súlyt tol fel egy görbe lejtőn. Ha egy súly feltolása a lejtő alapjával párhuzamos erővel történik, akkor a súlyt és a lejtő hajlásszögének tangensét összeszorozva megkapjuk a tolóerőt. A mi lejtőnk görbéjének függvénye: Gázunk izotermális kiterjedése közben a kp-os súlyt méter magasra emelte fel, tehát a munkavégzés mkp. Vagyis sikerült a munkát változó erő mellett is pontosan kiszámítani. De egy fontos dolgot ne feledjünk el. A mkp munkát nem a gramm héliumgáz végezte el. Ennek molekulái a kiterjedés befejeztével is ugyanakkora mozgási energiával röpdösnek, mint kiterjedés előtt. Az ideális gázként viselkedő héliumban levő összes energia csak a hőmérséklettől függ, nem pedig a térfogatától, nyomásától. A mkp munkavégzés a tartályból ered, annak az energiáját hasznosítottuk, a héliumgáz csak átvitte az energiát. Azt a mozgási energiát, amit a hélium átadott a dugattyúnak, a vörösrézfalon át azonnal pótolta a tartályból. Az izotermális kiterjedés munkavégzését képletben is felírhatjuk, és távolságok aránya ugyanaz, mint és térfogatoké. A logaritmus előtt álló szorzó a Kelvin-fokban adott hőmérséklettel arányos, ezért az a munka, amelyet mkp-ban kapunk, ha mól gáz Kelvin-fokon térfogatról izotermálisan terjed ki térfogatra: Izotermálisan kiterjedő gázunk a nagy tartályból kiszívott energiából végez általunk hasznosítható munkát és így úgynevezett hőerőgép. De a héliumgáz egyszeri kiterjedésével nem vagyunk megelégedve, hiszen ezzel a munkavégzés befejeződött, úgy, mint amikor egy vízi erőmű tartályában levő víz lefolyt a turbinán át. Az volna a jó, ha a munkavégzést meg lehetne ismételni ugyanazzal a héliumgázzal és berendezéssel, ahányszor csak akarjuk. A vízierőműnél ez úgy volna lehetséges, ha a vizet újra felhordanánk. De ehhez pontosan ugyanaz a munkavégzés kellene, amit előbb nyertünk. Héliumgázunknál is megtehetnénk azt, hogy a dugattyút visszanyomjuk -ről térfogatra, de ehhez mkp munkát kellene végeznünk, amely energia a dugattyú visszatértével visszakerülne a tartályba. Így nincs értelme a dolognak. De tehetjük a következőt. Először kiterjesztjük a héliumot literről literre és kapunk mkp munkát, a kp felkerült a görbe lejtőn méter magasra. Ezután a hengerről lehúzzuk a hőmérsékletű tartályt és rátolunk egy másik hőtartályt, amelynek hőmérséklete . A hirtelen lehűlt héliumgáz nyomása atmoszféráról atmoszférára esik a aránynak megfelelően. Az méter magasra emelt kp-os vashengerből fenn hagyunk kp-ot, így a megmaradt kp-os súly a -os iránytangensű lejtőn ugyanazzal a kp-dal nyomja a gereblyét, amellyel a gáz nyomja atmoszférával az -es dugattyút. A 3. ábrán pont mutatja ezt az állapotot. Most engedjük, hogy a súly összenyomja a gázt literre, atmoszféra nyomásra. Ekkor mi végzünk munkát, mégpedig mkp-ot, amelyet a héliumgáz azonnal átad a hidegebb tartálynak. A 3. ábra pontjába jutottunk. Utolsó lépésünk, hogy a hengerről lehúzzuk a hidegebb tartályt és újra rá dugjuk a hőmérsékletűt. Ekkor a hélium hőmérséklete -re, nyomása atmoszférára emelkedik (ezeket az adatokat a 3. ábra pontjában találjuk meg). Az áttevések (, ) folyamán beálló energiaváltozások kiegyenlítik egymást, mert a gáz energiája csak a hőmérséklettől függ. Összegezzük a történteket. A gramm, héliumgáz pontosan eredeti állapotába került vissza, számára a kísérlet körfolyamat volt. Mi kaptunk mkp munkát, mert kp fent maradt méter magasan ( mkp). Ennek a munkavégzésnek az eredete: a meleg hélium kihozott a meleg tartályból mkp energiát, ebből azonban csak mkp-ot adott vissza a hidegebb tartálynak és mkp a mienk maradt. Kísérletünk folyamán a két tartályban változott az energiakészlet nagysága, számukra a kísérlet nem volt körfolyamat. A munkanyerés azért volt lehetséges, mert a hideg gázt alacsonyabb hőfoka és kisebb nyomása folytán kevesebb munkával sikerült eredeti térfogatára visszanyomni, mint amennyi munkát melegen kiterjedve kiadott. Mintha a vízierőmű lecsurgott vizét egy olyan helyen vinnénk vissza, ahol kisebb. A kapott mkp a melegebb hőtartályból eredt. Hatásfoknak nevezzük a hasznosított energia arányát a meleg tartályból kivett energiához viszonyítva: . Azonnal látjuk, hogy a hatásfok kiszámítható az abszolút hőmérsékletekkel: Ez a hatásfok-meghatározás onnan ered, hogy a meleg tartály energiája tüzelőanyag elégetéséből ered és számunkra csak a végzett munka hasznosítható. Befejezésül meg kell mondani, hogy ez a hatásfok az elképzelhető legjobb érték. Ha súrlódás van vagy a dugattyú pályája végén nekiütközik egy akadálynak stb., a hatásfok még rosszabb lesz. A valóságban a körfolyamatot sokszor megismételve a két tartály hőmérséklete mindig közelebb kerül egymáshoz, és a munkavégzés idővel lehetetlenné válik. Ezeknek az egyszerű dolgoknak alapos megértése teszi lehetővé a főtételek, az entrópia fogalmának megismerését. |