|
A szöveg csak Firefox böngészőben jelenik meg helyesen. Használja a fenti PDF file-ra mutató link-et a letöltésre. Mindenki ismeri a Linde-féle cseppfolyósítási eljárást, amely azon alapul, hogy a gázok kiterjesztéskor lehülnek. Tegyünk a készülékbe hidrogént. Várakozásunkkal ellentétben a komprimált hidrogén ahelyett, hogy kiterjesztéskor lehülne, felmelegszik. Vagyis a hidrogént ezzel a módszerrel nem lehet cseppfolyósítani. Ez az eredmény az első pillantásra nagyon meglepő. Úgy tűnik, mintha az energiamegmaradás törvényével jutottunk volna ellentétbe: nem tudjuk, honnan vette a gáz a felmelegedéshez szükséges hőenergiát. E probléma megoldásához kissé alaposabban meg kell ismerkednünk a gázok sajátosságaival.
A III. osztályos fizika tankönyvből ismeretes az egyetemes gáztörvény ideális gázokra, mely szerint konstans. Ezt az összefüggést a gázok molekulasúlynyi mennyiségére vonatkozóan alakban szokták írni, ahol , az univerzális gázállandó.
Ezen egyenlőség alapján azonban nem tudjuk megmagyarázni a fenti jelenséget, sőt még a közönséges gázok kiterjedésekor történő lehűlését sem, mert ha a szorzat állandó, akkor -nek is állandónak kell maradnia. ‐ Viszont a legtöbb gáz mégis lehűl. Hova tűnik ekkor az energia?
Ez is azt bizonyítja, hogy mennyire eltérnek a reális gázok az ideális gáztól, amelyről feltételeztük, hogy a molekulái között nem hatnak erők, és a molekulák ütközéskor úgy viselkednek, mint elenyészően kis méretű abszolút rugalmas gömböcskék. Ezeknek a hibáknak a kiküszöbölésére állította fel Van der Waals holland fizikus a gázok általános állapotegyenletét. Ő mutatott rá arra, hogy az állapotegyenletben nem szabad a gáz rendelkezésére álló összes térfogattal számolni, hanem ebből le kell vonni a molekulák által betöltött térfogatot, vagyis a fenti egyenlet így módosul:
, ahol az anyagi minőségre jellemző állandó. Ebből a nyomásra a következő értéket kapjuk: . A valóságban azonban a nyomás a molekulák közt fellépő vonzóerők miatt ennél valamivel kisebb. Ha ugyanis egy molekula a fal közvetlen közelében a fal felé halad, a szomszédai részéről kifejtett vonzóerők egy befelé irányuló erőt eredményeznek (gondoljunk csak a felületi feszültség analóg jelenségére), amely a falba ütköző molekula sebességét, impulzusát és ezzel együtt a falra gyakorolt nyomását is csökkenti. Ez a vonzóerő arányos a vonzó molekulák számával, ez pedig fordítottan arányos a térfogattal, ezért az egyes molekulákra kifejtett vonzás alakban írható, ahol állandó. A gáz felületegységre gyakorolt összes belső vonzása (vagyis a nyomás-csökkenés) a felületen levő egyes molekulákra kifejtett vonzásból adódik össze. Ezek száma azonban szintén fordítottan arányos a moltérfogattal: , ahol állandó. A molekulák kölcsönös vonzásából származó kohéziós nyomás , ahol a gáz anyagi minőségére jellemző állandó.
Tehát az edény falára ható eredő nyomás: .
Ezt rendezve kapjuk a Van der Waals-féle egyenletet: Az állandók értékei néhány gázra:
A Van der Waals állapotegyenlet birtokában most már konkrét példákon is megmutathatjuk, hogy az egyes gázok hőmérséklete törvényszerűen megváltozik a nyomásváltozás hatására, mégpedig a gáz anyagi minőségétől függően. A következő kísérletet végezzük el. (Hogy a külső légnyomással ne kelljen törődnünk, képzeljük az egészet légüres térben.)
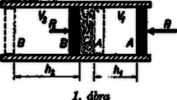 1. ábra
Vegyünk egy jó hőszigetelő anyagból készült q keresztmetszetű csövet. Ezt egy porózus testtel, pl. C vattacsomóval két részre osztjuk. A cső két végét egy-egy ideális dugattyú zárja le. Az A és C közti részbe helyezzük a vizsgálandó adott hőmérsékletű gáz 1 molnyi mennyiségét. Hogy a két oldalon az állandó nyomást biztosítsuk, a dugattyúkra állandó P1 és P2 erővel hatunk. Legyen P1>P2, ekkor az AC részből, ahol nyomás p1=P1q, a gáz eltolva a másik dugattyút, átáramlik a másik oldalra, ahol a nyomása p2=P2q, a két rész közt a nyomás kiegyenlítődését a C vattacsomó, az ún. ,,fojtási hely'' akadályozza meg, ugyanis időegység alatt csak adott mennyiségű gáz áramolhat át rajta. Így ez a nyomáskülönbség mindaddig fennmarad, amíg az A dugattyú teljesen át nem nyomja a gázt. A folyamat eredménye az, hogy a teljes gázmennyiség p1 nyomásról p2 nyomású lett.
Mint az előbb említettük, a kísérlettel az volt a célunk, hogy a nyomásváltozás közben a gáz ne kapjon és ne is adjon le energiát. Teljes hőszigetelést feltételezve, munkavégzés csak a két dugattyúnál volt lehetséges. A jobboldalon nekünk kellett L1=P1h1 munkát végeznünk, míg a baloldalon a gáz végzett L2=P2h2 munkát. A gáz belső energiája akkor marad változatlan, ha L1=L2, vagyis P1h1=P2h2. Felhasználva a nyomás és nyomóerő közti összefüggést: p1qh1=p2qh2, és bevezetve a qh1=V1 és qh2=V2 jelöléseket, a | p1V1=p2V2összefüggést kapjuk. | (1) |
(Vigyázzunk, ez nem azonos a Boyle-Mariotte-törvénnyel, mert itt egy szóval sem említettük, hogy a két állapotban a hőmérséklet azonos, sőt éppen a hőmérséklet-változást keressük !)
Másrészt tudjuk, hogy a gázra mindkét állapotában érvényes a Van der Waals-egyenlet:
(p1+aV12)(V1-b)=RT1,(2)(p2+aV22)(V2-b)=RT2.(3)
Így az (1), (2) és (3) egy egyenletrendszert alkot, amelyben V1, V2 és T2 az ismeretlenek. Ennek megoldását egy konkrét példán, éppen a hidrogén esetében végezzük el.
Vegyünk 1 molnyi, azaz 2 gramm hidrogént, amelynek nyomása p1=100 atm, hőmérséklete T1=0C∘=273,16K∘. Az előbb vázolt eszközben terjesszük ezt ki 1 atm-ra. Kérdés, hogy mennyi lesz ekkor a hőmérséklet ?
Először a (2) egyenletből meghatározzuk V1-et (ill. elegendő meghatározni p1V1-et). Beszorozva és átrendezve:
Mivel így harmadfokú egyenletet kapnánk, ezért egyszerűség kedvéért a korrekciós tagokban egy kis elhanyagolást végzünk. Feltehetően nem jelent lényeges eltérést, ha a jobboldalon levő V1-ek helyébe az ideális gáztörvény alapján kapott RT1p1 értéket helyettesítjük, ebből:
p1V1=RT1-ap1RT1+p1b+abp12R2T12=23,62atm lit/mol.(1)alapján, mivelp2=1atm:V2=p1V1/p2=23,62lit/mol.
Ezt behelyettesítve (3)-ba: T2=(p2+aV22)⋅(V2-b)R=287,73K∘,
tehát a hőmérséklet-növekedés: ΔT=14,57K∘.
Ugyanezt a kísérletet nitrogénnel elvégezve: V2=p1V1p2=21,31 lit, és T2=260,00K∘, tehát a hőmérséklet-növekedés: ΔT=-13,16K∘ (tehát hőmérséklet-csökkenés van). Ebből látható, hogy a hidrogén felmelegedése nem a véletlen műve, hanem a hidrogén tulajdonságaiból törvényszerűen következik. Nehogy azt gondoljuk azonban, hogy ez a felmelegedés a hidrogén egyedüli sajátsága, ugyanis bizonyos nyomáshatárok között minden gáz felmelegszik a kiterjesztés hatására. Ennek bizonyítására vizsgáljuk meg részletesebben a következő képletet: | ΔT=T2-T1=2aRT1-b-3abp1R2T12cp(p2-p1). |
Ez az itt nem részletezhető úton levezetett összefüggés explicite megadja minden gázra a kis Δp=p2-p1 nyomásváltozás hatására bekövetkező hőmérséklet-változást.
A továbbiakban egyszerűség kedvéért ennek a ΔT-nek csak az előjelét fogjuk vizsgálni. Mivel cp, az állandó nyomáson vett fajhő pozitív és Δp negatív (mivel p2<p1), ezért csak a μ=2aRT1-b-3abp1R2T12 kifejezés érdekel bennünket. Ha ide behelyettesítjük a hidrogén előző kísérletbeli adatait, akkor negatív értéket kapunk (tehát ΔT>0), ha pedig a nitrogén adatait helyettesítjük be, akkor pozitívat (tehát ΔT<0).
De ha az előző kísérletben a nitrogént nem 100 atm-ra, hanem mondjuk 500 atm-ra nyomjuk össze, és csak aztán terjesztjük ki, akkor ‐ mivel a μ=2⋅1,345R⋅273-0,0385-3⋅1,345⋅0,0385⋅500R2⋅273 kifejezés értéke körülbelül -0,07, vagyis negatív, ezért a nitrogén is felmelegszik (persze a kiterjesztés itt nem mehet 1 atm-ig, mert a fenti képlet csak kis p1-p2 esetén érvényes).
Viszont ha van olyan nyomás, amelyen kis kiterjedés esetén felmelegedés, ill. lehűlés következik be, akkor a kettő között kell lennie egy olyan nyomás-értéknek, ahol ez az előjelváltozás megtörténik. Ekkor μ=0, ebből:
Nitrogén esetén 0C∘-on p=250 atm.
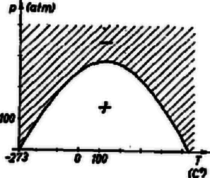 2. ábra
Ha más T hőmérsékleten vizsgáljuk a jelenséget, akkor természetesen más p értéket kapunk. Ha ezeket az összetartozó p-T értékeket koordináta rendszerben ábrázoljuk, akkor parabolát kapunk. Ugyanis -T2b-vel beszorozva a T2-2aRbT+ +3apR2=0 valóban egy parabola egyenlete, melynek görbéjét nitrogén esetén a 2. ábra mutatja.
A megfelelő (p;T) értékpárokat inverziós pontoknak nevezzük, az általuk meghatározott görbét pedig inverziós görbének. Ennek a görbének az a tulajdonsága, hogy az alatta levő (p;T) pontokra μ pozitív, vagyis az ilyen állapotú gáz esetén a nyomás-csökkenés mindig hőfok-csökkenéssel jár. A felette levő (p;T) pontokra pedig mindaddig a hőmérséklet emelkedésével jár, amíg olyan kicsi nyomáshoz nem érünk, hogy a (p;T) pont a görbe alá kerül.
Mivel a reális gázoknak az ideális gáztól való ilyen eltéréseit szabatosan elsőként Joule és Thomson vizsgálták klasszikus kísérleteikben, ezért ezt a jelenséget Joule‐Thomson-effektusnak nevezik.
Láthatjuk tehát, hogy a Van der Waals állapotegyenletből tisztán matematikai úton levezethető a gázok kiterjesztéskor fellépő hőfokváltozása, sőt annak nagyságára is jó közelítéssel szolgál.
Arra a problémára azonban, hogy a hidrogén esetén honnan keletkezik, a nitrogén esetén hová tűnik a hőenergia, ez az egyenlet sem ad választ. Erre a kérdésre a magyarázatot mélyebben, a molekulák közti kölcsönhatás részletesebb vizsgálatában kell keresnünk.
Ha a gáz nyomását változtatjuk, akkor megváltozik a térfogat-egységben levő molekulák száma, s így ezen molekulák átlagos távolsága. A továbbiakban éppen ez a távolság fog nagy szerepet játszani.
Egyszerűség kedvéért egyelőre csak két molekula állapotát vizsgáljuk egymástól mért távolságuk függvényében.
E két molekula között különböző okokból vonzó (P1) és taszító erő (P2) lép fel, amelyek fordítottan arányosak a köztük levő távolság bizonyos (κ1 és κ2) hatványával, így a következő alakban írhatjuk őket: ahol c1 és c2 jellemző anyagi állandók.
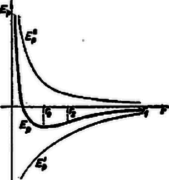
Hogy P1 vonzóerő, azt a negatív előjellel jelezzük. Pillanatnyilag tételezzük fel, hogy taszítóerő nem hat, ekkor ‐ ha el akarjuk egymástól távolítani a molekulákat, a vonzóerő ellen munkát kell végeznünk. Azt a munkát, amelyet akkor végzünk, amikor az egyik molekulát az adott r távolságból a végtelenbe visszük, a molekula helyzeti (potenciális) energiájának nevezzük. Ennek az r-től való függését a következő függvény írja le: E'pot=-c'rk1, ahol k1=κ1-1≈6, és c' állandó. (Azért negatív, mert az eltávolításhoz valahonnan máshonnan kell az energiát elvonni.) A görbe menetét a grafikon mutatja. 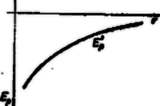 3. ábra
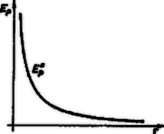
Ha pedig csak a taszítást vesszük figyelembe, akkor az erőtér végez munkát, miközben a molekulák távolodnak. Az az energia-mennyiség, amely a végtelenbe távolodáskor felszabadul, szintén a két molekula adott pontbeli potenciális energiáját jelenti, és nagysága E''pot=-c''rk2, ahol k2=κ2-1≈12, és c'' konstans.
 4. ábra
Mivel a valóságban a vonzás és taszítás mindig együttesen hat, ezért az eredő potenciális energia az előző kettő algebrai összegével lesz egyenlő: Ep=-c'rk1+c''rk2. Ep-t megkapjuk a molekulák távolságának függvényében, ha az előző két diagramot grafikusan összegezzük.
Mivel k1<k2, azért nagyon kicsi r esetén: a=E''pE'p=-c''rk1⋅rk1c'=c''c'⋅1rk2-k1, ahol -c''c' konstans, és rk2-k1 nagyon kicsi lévén a nagyon nagy lehet, vagyis E''p abszolut értéke mellett E'p elhanyagolható.
 5. ábra
Nagy r esetén azonban éppen fordítva áll a dolog, mert rk2-k1 nagyon nagy lehet. Ez összegezve azt jelenti, hogy Ep függvény kis r esetén azonosnak tekinthető E''p-vel, vagyis ezen a szakaszon a vonzóerők elhanyagolhatók. Nagy r esetén pedig az E'p-vel azonos, vagyis itt a taszítóerők hanyagolhatók el. Az átmeneti szakaszon a görbe minimumon megy át, mert előtte monoton fogyó, utána pedig növekedő.
Ezen előzetes megjegyzések után térjünk újra vissza a gázok kiterjesztésére, ill. összenyomására. A kiindulási állapotban olyan legyen a nyomás, hogy a molekulák távolsága a grafikonon jelzett viszonylag nagy r1 érték legyen. Nyomjuk össze a gázt annyira, hogy ez a távolság r2 legyen. Láthatjuk, hogy itt a molekulák kölcsönös helyzeti energiája csökkent, vagyis energia szabadult fel. Feltételezve, hogy a gáz zárt rendszert alkot, mivel ez az energia nem távozhat el, azért csak a molekulák mozgási energiájának a növelésére fordítódhat. De ez azt jelenti, hogy a gáz hőmérséklete növekszik, ugyanis a testek hőmérsékletét csak a molekulák közepes mozgási energiája, ω0¯ szabja meg: definíciószerűen T=2κω0¯. Vagyis ω0¯ növekedése maga után vonja T-ét is. (k a Boltzmann-állandó, értéke 1,3805⋅10-16 erg/fok.)
A nyomás növelésével mindaddig nő a hőmérséklet, amíg az átlagos távolság egy bizonyos r0-nál nagyobb, addig a pontig ugyanis a helyzeti energia csökken. Ezután azonban már helyzeti energianövekedés következik, amely hasonló okokból, mint előbb, most éppen a hőmérséklet csökkenésével jár.
Tehát ha bármilyen összetételű gázból indulunk ki, bár kezdetben az összenyomás hatására nőhet a hőmérséklet (amíg viszonylag nagy a molekulák átlagos távolsága), de egy bizonyos ponton a hőmérséklet-változás okvetlenül előjelet vált. Az ehhez az állapothoz tartozó (p;T) értékpár éppen a Van der Waals egyenletből levezetett inverziós ponttal azonos. Vegyük észre, hogy ha különböző kezdeti állapotokból indulunk ki (más a rendszer összes belső energiája), akkor a megfelelő (p;T) párok is különbözők lesznek.
Kiterjesztéskor persze éppen ellentétes folyamat játszódik le. Vagyis elég nagy nyomáson kiterjesztés hatására minden gáz felmelegszik. Hidrogén esetén már az 1 atm, nitrogénnél pedig csak több száz atm jelent ilyen elég nagy nyomást.
Végül megállapíthatjuk, hogy a folyamat molekuláris vizsgálata teljesen megszünteti az energetikai szempontból felmerült aggályainkat. Ugyanis az energia-megmaradás elvével megegyezésben itt sem történik egyéb, mint az energia egyik formájából (molekulák mozgási energiája) a másikba (kölcsönös helyzeti energia) történő átalakulása. Vesztergombi György |
 PDF | MathML
PDF | MathML 



