| Cím: | Az elektrolit oldatok elektromos vezetőképessége | ||
| Szerző(k): | Vermes Miklós | ||
| Füzet: | 1961/május, 225 - 229. oldal |  PDF | MathML PDF | MathML |
|
| Témakör(ök): | Szakmai cikkek | ||
|
A szöveg csak Firefox böngészőben jelenik meg helyesen. Használja a fenti PDF file-ra mutató link-et a letöltésre. Valamely anyag elektromosságot vezető képességét a fajlagos ellenállás , mint anyagállandó jellemzi. Hasábalakú, cm hosszúságú, keresztmetszet területű vezető ellenállása () egyenesen arányos a hosszúsággal és fordítva arányos a keresztmetszet területével: A anyagállandó a fajlagos ellenállás, megadja, hogy cm-es hosszúságú és -es alapterület mellett, vagyis A fajlagos ellenállás számértéke igen tág határok között mozog. A legjobb szigetelőanyagoknál Az elektrolit-oldatok áramvezetését vizsgálva a legelső kérdés, hogyan függ az oldat fajlagos ellenállása az oldat töménységétől ? A fajlagos ellenállás egyrészt a töltéshordozó iónok sűrűségétől, másrészt adott feszültség melletti mozgási sebességüktől (mozgékonyságuktól) függ, ezekkel fordítva arányos. De az elméleti megfontolások előtt lássuk a kísérleti tényeket. Az ebből a tárgykörből kiírt pályázatra beküldött dolgozatok egyikében, Náray-Szabó Gábor és Varsányi István dolgozatában találhatók az 1. táblázatunkban szereplő adatok. Az 1. rovat a nátriumklorid oldat százalékos töménységét, a 2. rovat az oldat 1. táblázat 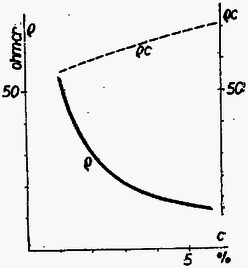 Azonnal látható; hogy nagyobb töménység mellett kisebb a fajlagos ellenállás. Ez várható is, hiszen töményebb oldatban nagyobb az iónok sűrűsége, és emiatt ugyanilyen arányban csökkennie kell a fajlagos ellenállásnak. Fordított arányosságot, a grafikus ábrában hiperbolát várunk. Ez első látásra teljesül is, de ránézésre nehéz megállapítani, vajon a görbe tényleg hiperbola-e. Ezért 1. táblázatunk 3. oszlopában és az 1. ábra szaggatott vonalával feltüntetjük a 2. táblázat 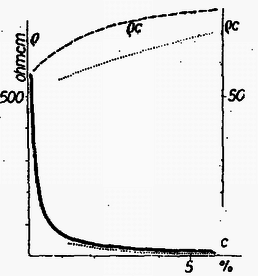 Mi lehet a fordított arányosságtól való eltérés oka ? Ezt Debye és munkatársai 1923-ban derítették ki. Sók oldatában (például az általuk vizsgált nátriumklorid oldatban) a feloldott anyag teljes mennyisége áramvezetésben közreműködő iónok alakjában van jelen, amelyek mindegyike részt vesz az áram vezetésében. Ebből a fajlagos ellenállás számára a töménységgel való szigorú fordított arányosság következne. Azonban változik az iónok mozgékonysága. Ennek oka az iónok közötti elektrosztatikus vonzóerő. Az ellenkező töltésű, egymással összekevert iónok kölcsönös elektrosztatikus erejéből egy akadályozó erő származik, amely annál inkább zavarja az iónok mozgását, minél töményebb az oldat. A Debye által talált összefüggés így adja meg a fajlagos ellenállásnak a töménységtől való függését: 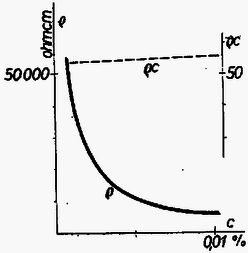 Amit most láttunk, az minden só oldatára érvényes, tekintet nélkül arra, hogy a kérdéses só erős vagy gyenge savból, illetve bázisból származik-e. Mindezek a sók kristályos alakjukban iónokból épülnek fel, amelyek oldódás után szabadon úsznak a vízben, és létrejön a nátriumklorid esetében megismert jelenség. De találunk az elektrolitek között másként viselkedőket is. Nézzük meg az idézett pályázatra benyújtott dolgozatok egyikében Nagy Dénes Lajos és Szegi András méréseit ammóniumhidroxid oldatokra vonatkozóan (3. táblázat és 3. ábra). Itt már nyoma sincs a fordított arányosságnak, 3. táblázat 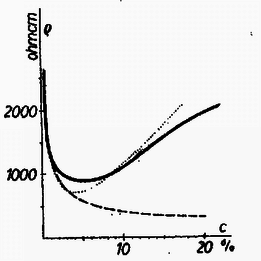 Ugyanezt látjuk Kohlrausch 1876-ból származó, ammóniumhidroxidra vonatkozó észleléseinél (4. táblázat 1 és 2. rovata, a 4. ábra folytonos vonala; a pontozott vonal Nagy Dénes Lajos és Szegi András adatait mutatja). Itt egészen más a kísérleti eredmény, mint nátriumklorid esetében, és a fordított arányosság teljes hiánya más megokolást kíván. Már 1887-ben Arrhenius és 1888-ban Ostwald megadták a jelenség magyarázatát. Az ammóniumhidroxid oldatban túlnyomórészt 4. táblázat 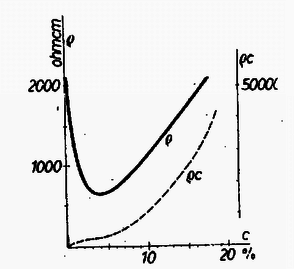 ezek a töltött iónok közvetítik azután az áramvezetést. Az iónokra történő szétesés igen kis mértékű, és függ az oldat töménységétől. Ostwald a termodinamikán alapuló tömeghatás törvényével megmutatta, hogy a disszociáció foka ( Az ammóniumhidroxidhoz hasonló viselkedést tapasztalunk a gyenge savak és gyenge bázisok oldatainál, az úgynevezett gyenge elektroliteknél. Annak idején a kémikusok és fizikusok először a gyenge elektrolitek viselkedését magyarázták meg a fenti módon, és ugyanilyen alapon akarták megokolni az erős elektrolitek, a sóoldatok viselkedését is, ami természetesen nem sikerült. Végül is, majdnem fél évszázad múltán Debye adta meg ezek számára a helyes magyarázatot. Végül meg kell jegyeznünk, hogy az erős savak, köztük a kétbázisú savak bizonyos szempontból átmeneti helyet foglalnak el a két csoport között. Az elméleti számítások különben is csak híg oldatokra vonatkoznak. 1Használatos még a fajlagos ellenállás |